若X、Y、Z均为短周期元素,X元素原子最外层电子数为1,Y元素原子的M层上有7个电子;Z元素原子的最外层电子数是次外层电子数的3倍。由X、Y、Z组成化合物的化学式不可能的是
| A.XYZ2 | B.XYZ4 | C.XYZ | D.X2YZ3 |
关于常温下pH = 12的NaOH溶液,下列说法正确的是
| A.c(OH-) > c(Na+) + c(H+) |
| B.由水电离出的c(OH-) = 1.0×10-12 mol·L-1 |
| C.与等体积pH = 2的醋酸混合后所得溶液显碱性 |
| D.与等体积0.01 mol·L-1氯化铵溶液混合后所得溶液中:c(Na+) = c(NH4+) |
将CO2转化为甲醇的原理为 CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH <0。500 ℃时,在体积为1 L的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是
CH3OH(g)+H2O(g) ΔH <0。500 ℃时,在体积为1 L的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是
| A.曲线X可以表示CH3OH(g)或H2O(g)的浓度变化 |
| B.从反应开始到10min时,H2的反应速率v(H2)="0.225" mol/(L·min) |
| C.平衡时H2的转化率为75% |
| D.500 ℃时该反应的平衡常数K=3 |
下图表示反应N2(g) + 3H2(g)  2NH3(g) ΔH=-92.2 kJ/mol。在某段时间t0~t6中反应速率与反应过程的曲线图如下,则氨的百分含量最高的一段时间是
2NH3(g) ΔH=-92.2 kJ/mol。在某段时间t0~t6中反应速率与反应过程的曲线图如下,则氨的百分含量最高的一段时间是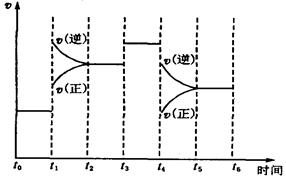
| A.t0~t1 | B.t2~t3 |
| C.t3~t4 | D.t5~t6 |
已知1 g氢气完全燃烧生成液态水时放出热量143 kJ,18 g水蒸气变成液态水放出44kJ的热量。其它相关数据如下表:
| O=O(g) |
H-H(g) |
H-O(g) |
|
| 1mol化学键断裂时需要吸收的能量/kJ |
496 |
X |
463 |
则表中X为
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
体积相同的甲乙两个容器中,分别充有等物质的量的SO2、O2,使压强刚好与外界相等。在相同温度下,发生2SO2+O2 2SO3并达到平衡。在这个过程中,甲容器保持体积不变,乙容器保持压强不变。若甲容器中SO2的转化率为α,则乙容器中SO2的转化率为
2SO3并达到平衡。在这个过程中,甲容器保持体积不变,乙容器保持压强不变。若甲容器中SO2的转化率为α,则乙容器中SO2的转化率为
| A.等于α | B.大于α | C.小于α | D.无法确定 |