元素的原子结构决定其性质和在周期表中的位置。下列说法正确的是:
| A.元素原子的最外层电子数等于元素的最高化合价 |
| B.多电子原子中,在离核较近的区域内运动的电子能量较高 |
| C.P、S、Cl得电子能力和最高价氧化物对应的水化物的酸性均依次增强 |
| D.元素周期表中位于金属和非金属分界线附近的元素称为过渡元素 |
食盐晶体如下图所示。在晶体中,·表示Na+,o表示Cl-。已知食盐的密度为r g/cm3,NaCl摩尔质量M g/mol,阿伏加德罗常数为N,则在食盐晶体里Na+和Cl-的间距大约是
A. cm cm |
B.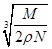 cm cm |
C. cm cm |
D.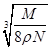 cm cm |
某离子化合物的晶胞如右图所示立体结构,晶胞是整个晶体中最基本的重复单位。阳离子位于此晶胞的中心,阴离子位于8个顶点,该离子化合物中,阴、阳离子个数比是
| A.1∶8 | B.1∶4 | C.1∶2 | D.1∶1 |
石墨晶体是层状结构,在每一层内;每一个碳原于都跟其他3个碳原子相结合,如下右图是其晶体结构的俯视图,则图中7个六元环完全占有的碳原子数是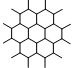
| A.10个 | B.18个 | C.24个 | D.14个 |
有关乙炔分子中的化学键描述不正确的是
| A.两个碳原子采用sp杂化方式 |
| B.两个碳原子采用sp2杂化方式 |
| C.每个碳原子都有两个未杂化的2p轨道形成π键 |
| D.两个碳原子形成两个π键 |
在x mol石英晶体中,含有Si-O键数是
| A.x mol | B.2x mol | C.3 x mol | D.4x mol |