将 4 mol A 气体和 2 mol B 气体在 2 L 的容器中混合并在一定条件下发生如下反应 2A(气)+B(气) 2C(气)若经 2 秒后测得 C 的浓度为0.6 mol·L-1 ,现有下列几种说法:①用物质 A 表示反应的平均速率为 0.3 mol·L-1·s-1②用物质 B 表示的反应的平均速率为 0.6 mol·L-1·s-1③ 2 s 时物质 A 的转化率为30% ④ 2 s 时物质 B 的浓度为 1.4 mol·L-1 ,其中正确的是
2C(气)若经 2 秒后测得 C 的浓度为0.6 mol·L-1 ,现有下列几种说法:①用物质 A 表示反应的平均速率为 0.3 mol·L-1·s-1②用物质 B 表示的反应的平均速率为 0.6 mol·L-1·s-1③ 2 s 时物质 A 的转化率为30% ④ 2 s 时物质 B 的浓度为 1.4 mol·L-1 ,其中正确的是
| A.①④ | B.①③ | C.②③ | D.③④ |
下列有关配合物的论述不合理的是
| A.Na[Al(OH)4]和[Ag(NH3)2]OH都是配合物 |
| B.Na3[AlF6]、Na2[SiF6]和[Cu(NH3)4]Cl2的配位数都是6 |
| C.[ZnCl4]2-的空间构型为正四面体形 |
| D.配合物[Cr(H2O)4Br2]Br·2H2O中,中心离子的化合价为+3价,配离子带1个单位的正电荷 |
下列反应的离子方程式正确的是
| A.碳酸镁溶于硝酸中:CO32-+2H+ ="==" H2O+CO2↑ |
| B.AlCl3水解反应:Al3+ + 3H2O ="==" Al(OH)3↓ + 3H+ |
| C.向稀氨水中加入稀盐酸:NH3·H2O + H+="==" NH4++ H2O |
D.纯碱水解反应:CO32-+ 2H2O H2CO3+ 2OH- H2CO3+ 2OH- |
下列说法正确的是
| A.冰溶化时,分子中H—O键发生断裂 |
| B.在晶体中只要有阳离子,一定有阴离子 |
| C.离子化合物中可能含有非极性共价键 |
| D.在SiO2晶体中,Si原子与Si—O键数目比为1:2 |
100 mL pH=2的两种一元酸x和y,稀释过程中pH与溶液体积的关系如图所示。下列说法正确的是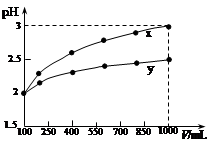
| A.稀释前x、y的物质的量浓度相等 |
| B.x为强酸,y为弱酸 |
| C.随着稀释的进行,y的电离程度减小 |
| D.等体积的x、y分别分别与足量的锌反应,x放出的氢气多 |
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
| A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。 |
| B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。 |
| C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。 |
| D.以上说法都不正确。 |