在相同温度和压强下,对反应CO2(g)+H2(g) 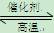 CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表,上述四种情况达到平衡后,n(CO)的大小顺序是
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表,上述四种情况达到平衡后,n(CO)的大小顺序是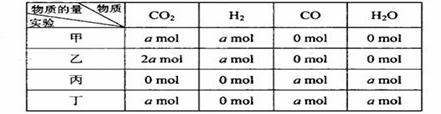
| A.乙=丁>丙=甲 | B.乙>丁>甲>丙 |
| C.丁>乙>丙=甲 | D.丁>丙>乙>甲 |
下列离子方程式正确的是
| A.次氯酸钙溶液中通入过量二氧化碳: Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO |
| B.常温时偏铝酸钠溶液pH>7:AlO2-+2H2O=Al(OH)3↓+OH- |
| C.等物质的量浓度的FeI2溶液与溴水等体积混合: 2Fe2++2I-+2Br2=2Fe3++I2+4Br- |
| D.向硫酸氢钠溶液中滴加Ba(OH)2溶液恰好至中性: |
2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
已知一种C(H+)=1×10—3mol·L-1的酸和一种C(OH—)= 1×10—3mol·L-1的碱溶液等体积混合后溶液显碱性,其原因可能是
| A.浓的强酸和稀的强碱溶液反应 |
| B.生成了一种强碱弱酸盐 |
| C.浓的弱碱和稀的强酸溶液反应 |
| D.等物质的量浓度的一元弱酸和一元强碱溶液反应 |
元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测正确的是.
| A.H2Z是含极性键的非极性分子 |
| B.原子半径X>Y,离子半径X+>Z2- |
| C.同族元素中Z的氢化物沸点最低 |
| D.XYZ3的晶体类型是离子晶体 |
阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是
| A.4 g重水(D2O)中所含质子数为0.2×6.02×1023 |
| B.2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2×6.02×1023 |
| C.4.48 L H2和O2的混合气体中所含分子数为0.2×6.02×1023 |
| D.0.1 mol Cl2溶解于NaOH溶液中,转移电子数为0.2×6.02×1023 |