下列热化学方程式中,正确的是( )
| A.甲烷的燃烧热ΔH="-" 890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH="-890.3" kJ·mol-1 |
B.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为: N2(g)+3 H2(g) 2 NH3(g) ΔH =" -38.6" kJ·mol-1 2 NH3(g) ΔH =" -38.6" kJ·mol-1 |
| C.HCl和NaOH反应的中和热ΔH=" -57.3" kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1 |
| D.在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2 H2(g)+O2(g)="2" H2O(l) ΔH=" -571.6" kJ·mol-1 |
工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3气体,已知该反应为放热反应。现将2 mol SO2、1 mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%,则下列热化学方程式正确的是
A.2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1 2SO3(g) ΔH=-196.6 kJ·mol-1 |
B.2SO2(g)+O2(g) 2SO3(g) ΔH=-98.3 kJ·mol-1 2SO3(g) ΔH=-98.3 kJ·mol-1 |
C.SO2(g)+ O2(g) O2(g) SO3(g) ΔH=+98.3 kJ·mol-1 SO3(g) ΔH=+98.3 kJ·mol-1 |
D.SO2(g)+ O2(g) O2(g) SO3(g) ΔH=-196.6 kJ·mol-1 SO3(g) ΔH=-196.6 kJ·mol-1 |
在容积一定的密闭容器中,发生可逆反应:A(g)+B(g) xC(g),有如图(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线,则下列说法中正确的是
xC(g),有如图(T表示温度,P表示压强,C%表示C的体积分数)所示的反应曲线,则下列说法中正确的是
| A.x=2,T1>T2,P2>P1 |
| B.P3>P4,y轴表示B的质量分数 |
| C.P3<P4,y轴表示混合气体的密度 |
| D.P3>P4,y轴表示混合气体的平均摩尔质量 |
一定温度下,1molX和nmolY在体积为2L的密闭容器中发生如下反应:X(g)+Y(g) 2Z(g)+M(s),5min后达到平衡,此时生成2amolZ。下列说法正确的是
2Z(g)+M(s),5min后达到平衡,此时生成2amolZ。下列说法正确的是
| A.用X表示此反应的反应速率是(0.1-0.2a)mol·(L·min)-1 |
| B.当混合气体的质量不再发生变化时,说明反应达到平衡状态 |
| C.向平衡后的体系中加入1molM,平衡向逆反应方向移动 |
| D.向上述平衡体系中再充入1molX,v(正)增大,v(逆)减小,平衡正向移动 |
汽车尾气中,产生NO的反应为:N2(g)+O2(g)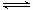 2NO(g),一定条件下,等物质的量的N2(g)和O2(g).在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是
2NO(g),一定条件下,等物质的量的N2(g)和O2(g).在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始条件改变时N2的浓度随时间的变化。下列叙述正确的是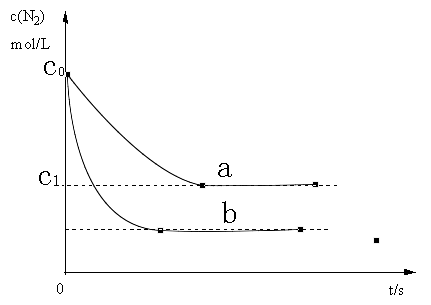
A.温度T下,该反应的平衡常数K= |
| B.温度T下,随着反应的进行,混合气体的密度减小 |
| C.曲线b对应的条件改变可能是加入了催化剂 |
| D.若曲线b对应的条件改变是温度,可判断该反应的△H<0 |
某温度下,H2(g)+CO2(g) H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=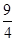 。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
| 起始浓度 |
甲 |
乙 |
丙 |
| c(H2)/mol/L |
0.010 |
0.020 |
0.020 |
| c(CO2)/mol/L |
0.010 |
0.010 |
0.020 |
下列判断不正确的是
A.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
B.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
C.平衡时,乙中CO2的转化率大于60%
D.平衡时,甲中和丙中H2的转化率均是60%