下列描述的一定是金属元素的是
| A.易失去电子的物质 | B.原子核内有11个质子的元素 |
| C.原子的最外电子层只有1个电子的元素 | D.能与酸反应的物质 |
下列说法不正确的是
| A.一个可逆反应达到的平衡状态就是这个反应在该条件下所能达到的限度 |
| B.常温下,向Mg(OH)2饱和溶液中加入NaOH溶液,Mg(OH)2的Ksp不变 |
| C.带有“盐桥”的铜锌原电池比不带“盐桥”的铜锌原电池电流持续时间长 |
| D.对滴加酚酞的NaHCO3溶液加热,红色加深,是因为加热时NaHCO3分解生成Na2CO3,碱性增强 |
已知反应:CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41 kJ·mol-1和2H2(g)+O2(g)===2H2O(g) ΔH=-484 kJ·mol-1。则下列说法不正确的是
| A.CO转化为CO2的热化学方程式为2CO(g)+O2(g)===2CO2(g)ΔH=-566 kJ·mol-1 |
B.CO燃烧热的热化学方程式为CO(g)+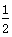 O2(g)===CO2(g) ΔH=-283 kJ·mol-1 O2(g)===CO2(g) ΔH=-283 kJ·mol-1 |
| C.放热反应可能需要加热才能进行,而吸热反应一定需要加热才能进行 |
| D.1mol H2完全燃烧生成1mol 液态水,放出的热量大于242 kJ |
已知同温度下,三种酸的电离平衡常数的大小关系为Ka(HX)>Ka(HY)>Ka(HZ),则物质的量浓度相同的三种盐NaX、NaY和NaZ溶液pH由大到小的顺序是
| A.NaX NaY NaZ | B.NaX NaZ NaY |
| C.NaY NaZ NaX | D.NaZ NaY NaX |
下列叙述中不正确的是
| A.将NaAlO2溶液在蒸发皿中蒸干,最终得到的固体物质是Al(OH)3 |
| B.溶液中c(H+)>c(OH—),该溶液一定显酸性 |
| C.用原电池作电源进行电解时,电子从原电池负极流向电解池阴极 |
| D.外加电流的阴极保护法,构成了电解池;牺牲阳极的阴极保护法构成了原电池 |
某温度下,Kw=10—13,已知该温度下某浓度Na2CO3溶液的pH=10,则该溶液中由水电离的c(OH—)是
| A.1×10—10 mol/L | B.1×10—3 mol/L |
| C.1×10—4 mol/L | D.1×10—7 mol/L |