下列有关实验原理、方法和结论都正确的是
| A.向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,该溶液中不一定含有SO42- |
| B.向蛋白质溶液中加入硫酸铜溶液,将得到的沉淀分离出来,再加水可重新溶解。 |
| C.等体积的PH都为3的酸HA和HB分别与足量的Mg反应,HA放出的H2多,说明酸性:HA>HB |
| D.淀粉在稀硫酸的作用下水解后,加入氢氧化钠使溶液呈碱性,再加入新制Cu(OH)2后加热,若有砖红色沉淀生成,则淀粉已经完全水解。 |
下列有关图像说法正确的是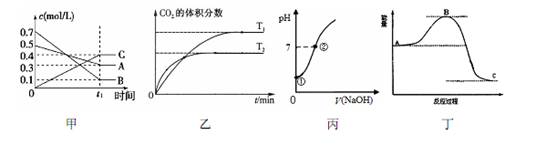
A.图(1)表示反应的方程式为5A(g)+7B(g) 4C(g) 4C(g) |
B.图(2)表示反应5CO(g) + I2O5(s) 5CO2(g) + I2(s) △H<0 5CO2(g) + I2(s) △H<0 |
| C.图(3)表示向饱和氯水中逐滴滴入0.1mol·L-1的氢氧化钠溶液的pH 变化,①到②水的电离程度逐渐减小 |
| D.图(4)表示4H2(g) + 2NO2(g)=N2(g) + 4H2O(g)反应过程的能量变化,加入催化剂,将使C 点降低 |
电解NO 制备NH4NO3,其工作原理如图所示。下列说法中正确的是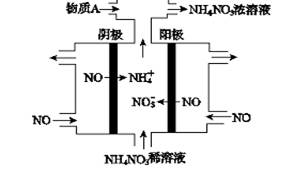
| A.阳极上的电极反应为:NO—3e-+ 4OH-= NO3-+ 2H2O |
| B.电解生成1 mol NH4NO3时,转移5NA电子 |
| C.电解质溶液中,NO3-离子向阴极移动 |
| D.为了使电解产物全部转化为NH4NO3,需补充的物质A为稀硝酸 |
能正确表示下列反应的离子方程式是
| A.氢氧化钡溶液与过量稀硫酸反应:Ba2++OH-+SO42-+H+=H2O+BaSO4↓ |
| B.碳酸氢钙与过量的NaOH 溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
| C.氯化铝溶液与过量的氨水反应:Al3++4OH-=AlO2-+2H2O |
| D.稀硝酸与过量的铁屑反应:3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O |
下列实验操作正确的是
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为14。X 与Y、 Z位于相邻周期,X原子内层电子数与Y原子最外层电子数相等,Z原子最外层电子数比X的最外层电子数多2。下列说法正确的是
| A.Y的氧化物是离子化合物 |
| B.X的氢化物溶于水显酸性 |
| C.常温时Z单质的氧化性比X单质的氧化性弱 |
| D.X和 Z的最高价氧化物对应的水化物都是弱酸 |