关于化学反应与能量的说法正确的是( )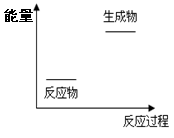
| A.根据上图提供的信息,该反应是放热反应 |
| B.化学变化中的能量变化主要由化学键变化引起的 |
| C.化学反应中只伴随热量的变化 |
| D.CaCO3(s)==CaO(s)+CO2(g) ΔH="+178.5" KJ·mol-1的意义是表示1mol CaCO3完全.分解生成1mol CaO和1mol CO2气体要放出178.5 KJ的热量 |
室温下,取0.3 mol·L-1HY溶液与0.3 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=9,则下列说法(或关系式)正确的是 ( )
| A.混合溶液中由水电离出的c(OH-)=10-9 mol·L-1 |
| B.溶液中离子浓度由大到小的顺序为c(Y-)>c(Na+)>c(OH-)>c(H+) |
| C.混合溶液中c(Na+)=c(Y-)+c(HY)=0.3 mol·L-1 |
| D.混合溶液中c(OH-)-c(HY)=c(H+)=1×10-9 mol·L-1 |
已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol·L-1的一元酸HA与b mol·L-1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是 ( )
| A.a=b |
| B.混合溶液的pH=7 |
C.混合溶液中,c(H+)= mol·L-1 mol·L-1 |
| D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-) |
室温下,在pH为5的NH4Cl溶液、pH为9的NaHCO3溶液和pH为5的盐酸中,水的电离度分别为:α1、α2、α3,它们之间的大小关系是 ( )
| A.α1<α2<α3 | B.α1=α2>α3 | C.α1>α2>α3 | D.无法判断 |
下图是向100 mL的盐酸中逐渐加入NaOH溶液时,溶液的pH变化图像,根据如图所得结论正确的是 ( )
| A.原来盐酸的物质的量浓度为0.1 mol·L-1 |
| B.NaOH溶液的浓度为0.1 mol·L-1 |
| C.原来盐酸的物质的量浓度为1 mol·L-1 |
| D.NaOH溶液的浓度为0.01 mol·L-1 |
室温下,取0.2 mol·L-1CH3COOH溶液与0.2 mol·L-1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,则下列说法(或关系式)正确的是 ( )
| A.混合溶液中由水电离出的c(H+)=10-8 mol·L-1 |
| B.溶液中离子浓度由大到小的顺序为c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| C.混合溶液中c(Na+)=c(CH3COOH)+c(CH3COO-)=0.2 mol·L-1 |
| D.混合溶液中c(OH-)-c(CH3COOH)=c(H+)=1×10-8 mol·L-1 |