已知X、Y、Z都是第三周期元素,且核电荷数依次增大,X的最高价氧化物对应水化物为强碱,Z的原子半径在第三周期(除稀有气体外)最小。据此判断下列说法不正确的是
| A.X是ⅠA元素,Z是VIIA元素 |
| B.X、Y、Z三种元素的最高化合价逐渐减小 |
| C.Z的最高价氧化物对应的水化物是强酸 |
| D.X、Z形成的化合物是离子化合物 |
某有机物的结构是:关于它的性质的描述正确的是( )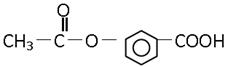
①能发生加成反应;②能溶解于NaOH溶液中;③能水解生成两种有机物;
④不能使溴水褪色;⑤能发生酯化反应;⑥有酸性
| A.①②③ | B.②③⑤ | C.仅⑥ | D.全部正确 |
下列关于有机物的说法中正确的是 ( )
①棉花、蚕丝和人造丝的主要成分都是纤维素
②淀粉、油脂、蛋白质在一定条件下都能发生水解
③有机物完全燃烧后都只能生成二氧化碳和水
④除去乙酸乙酯中残留的乙酸,加过量饱和Na2 CO3溶液振荡后,静置分液
⑤塑料、橡胶和光导纤维都是合成高分子材料
⑥石油的分馏、裂化和煤的干馏都是化学变化
| A.①⑤⑥ | B.②④ | C.①②③⑤ | D.③④⑤⑥ |
下列有关有机化合物的性质和用途的说法正确的是 ( )
| A.乙烯分子与苯分子中碳碳键不同,但二者都能发生加成反应 |
| B.乙烯、聚氯乙烯结构中都含有碳碳双键 |
| C.乙醇既可以作燃料,也可以在日常生活中使用,如无水乙醇可用于杀菌、消毒 |
| D.一溴甲烷与1,2—二溴乙烷互为同分异构体 |
将1mol N2和3 mol H2通入4L的密闭容器中反应,半分钟后测得H2的物质的量为2.1 mol,现用如下三种物质在单位时间内的浓度变化来表示该反应速率:
① v(H2) =" 0.45" mol/(L·min)② v(N2) =" 1.05" mol/(L·min) ③ v(NH3) =" 0.30" mol/(L·min)其中正确的是 ( )
| A.①② | B.②③ | C.①③ | D.①②③ |
短周期金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是( )
| A.原子半径:丙<丁<戊 | B.金属性:甲>丙 |
| C.氢氧化物碱性:丙>丁>戊 | D.最外层电子数:甲>乙 |