0.1 mol某液态烷烃完全燃烧需要消耗0.8 mol 氧气,写出符合该物质化学式的烷烃的结构简式并写出每种物质系统命名的名称
工业上以黄铜矿(主要成分是CuFeS2,杂质不溶于水和酸)为原料,制备蓝色晶体G,其化学式为[Cu(NH3)4]SO4·H2O,涉及流程如下: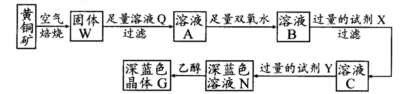
已知25℃时,几种金属氢氧化物的溶度积常数和完全沉淀的pH范围如下表:
| Fe(OH)2 |
Cu(OH)2 |
Fe(OH)3 |
|
| Ksp |
8.0×10-16 |
2.2×10-22 |
4.0×10-38 |
| 完全沉淀pH |
≥9.6 |
≥6.4 |
≥3.2 |
(1)加快黄铜矿焙烧速率,可采用的措施有(写两种):
(2)加入双氧水可能发生反应的离子方程式为;
试剂X的化学式为。
(3)常温下,0.1 mol/L试剂Y的pH=11,则该温度下,试剂Y的电离常数为;
用pH试纸测该溶液pH值的方法是
(4)已知Cu(OH)2+4NH3·H2O [Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式:。
[Cu(NH3)4]2++2OH-+4H2O,写出该反应的平衡常数表达式:。
(5)在溶液N中加入乙醇的目的是。
(15分)
呋喃酚是合成农药的重要中间体,其合成路线如下: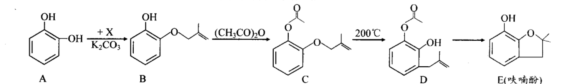
(1)B→C的反应类型是;E中含有的官能团名称是。
(2)已知X的分子式为C4H7C1,写出A→B的化学方程式:
(3)Y是X的同分异构体,分子中无支链且不含甲基,则Y的名称(系统命名)是
(4)下列有关化合物C、D的说法正确的是(填代号)。
A.可用氯化铁溶液鉴别C和DB.C、D含有的官能团完全相同
C.C、D互为同分异构体D.C、D均能使溴水褪色
(5)E的同分异构体很多,写出符合下列条件的芳香族同分异构体的结构简式:
①苯环上的一氯代物只有一种②含有酯基③能发生银镜反应
X、Y、Z、W、T是元素周期表中前四周期的五种元素。有关这五种元素的信息如下表:
| 元素代号 |
相关信息 |
| X |
它的一种核素的原子核内没有中子 |
| Y |
能组成很多种性质不同的单质,也是形成化合物种类最多的一种元素 |
| Z |
基态原子的最外层电子排布式为nsnnpn+1 |
| W |
与钾元素能组成多种化合物,这些化合物与水反应均生成碱;大气平流层中W3被誉为地球生物“保护伞” |
| T |
主要化合价有+1和+2价,且[T(X2W)4]2+和[T(ZX3)4]2+均呈蓝色 |
请推出具体元素,用具体元素回答下列问题:
(1)根据元素周期律可以设计出多种形式的周期表,下列是扇形元素周期表: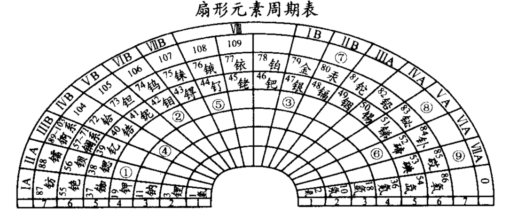
T元素在扇形元素周期表中的位置是(填表中带圆圈的数字);上表中⑨号位置的元素基态原子未成对电子数为;2012年6月25日,俄罗斯杜布纳核联合研究所再次成功合成117号元素,它将被列入元素周期表,“117”元素在扇形元素周期表中的位置是(填表中带圆圈的数字)。
(2)质量数为2的X基态原子的电子排布式为,在这五种元素中电负性最大的是。
(3)由上述五种元素中的某些元素形成的离子,该离子中每个原子最外层均有8个电子且与Z3-具有相同质子数和电子数,则这种离子的结构式为。
(4)TW在高温条件下是一种优良的氧化剂,它能将很多有机化合物完全氧化(相当于完全燃烧),写出高温条件下,TW与Y最简单的氢化物反应的化学方程式:。
(5)已知在25℃、101 kPa下:
XYZ(aq)+X2W(1)  YZ- (aq)+X3W+(aq) ΔH="+45.6" KJ/mol
YZ- (aq)+X3W+(aq) ΔH="+45.6" KJ/mol
X3W+(aq)+WX(aq)=2X2W(1)ΔH="-57.3" KJ/mol
则在25℃、101 kPa的稀溶液中,XYZ与WX反应的热化学方程式(以离子厅程式表示):。
ZnO具有抗菌性,也是重要的轮胎添加剂。工业上由粗ZnO(含FeO、CuO)制备活性ZnO流程如下: 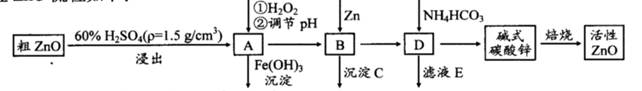
已知此溶液中Fe2+、Fe3+、Cu2+、Zn2+形成氢氧化物的pH如下表:
| 离子 |
开始沉淀的pH |
完全沉淀的pH |
| Fe2+ |
6.4 |
8.4 |
| Fe3+ |
2.4 |
3.1 |
| Cu2+ |
5.2 |
6.7 |
| Zn2+ |
6.8 |
9 |
(1)实验室中用98%H2SO4来配制100 mL60%稀硫酸所需使用的玻璃仪器有:烧杯、量筒、、、。
(2)写出在A中加H2O2的离子方程式:。
(3)向A中可以加入(写化学式)调节溶液pH范围在之间;沉淀C为。
(4)碱式碳酸锌[Zn3(OH)4CO3·H2O]焙烧制备活性ZnO的化学方程式为。
苯酚是重要的工业原料之一,工业上采用苯酚合成有机物D的路线如下:
请回答下列问题:
(1)有机物A分子官能团是(写名称)。B的结构简式是,其核磁共振氢谱图中有种峰。
(2)C→D的反应类型是,D与足量NaOH溶液共热时反应的化学方程式:
(3)X是B的同分异构体,X分子中含有苯环,其中苯环上一氯代物只有两种,且能发生银镜反应,则X的所有结构简式有 、、、。
、、、。
(4)有关化合物C的说法正确的是(填字母)
| A.能发生加成反应 |
| B.一定条件下,可以在NaOH醇溶液中发生消去反应 |
| C.1molC与足量NaOH溶液共热,最多消耗2molNaOH |
| D.属于酯类物质 |