已知Ksp(AgCl )=1.8×10-10,Ksp(AgI)=1.0×10-16。下列关于不溶物之间转化的说法中错误的是( )
| A.AgCl不溶于水,不能转化为AgI |
| B.两种不溶物的Ksp相差越大,不溶物就越容易转化为更难溶的不溶物 |
| C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必不低于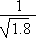 ×10-11 mol·L-1 ×10-11 mol·L-1 |
铜锌原电池装置(见图),下列分析正确的是
| A.一段时间后两烧杯中c(Zn2+)、c(Cu2+)均减小 |
| B.原电池工作时,Cu电极流出电子,发生氧化反应 |
| C.原电池工作时的总反应为Zn+Cu2+=Zn2++Cu |
| D.盐桥中装有含氯化钾的琼脂,其作用是传递电子 |
解释下列事实的化学用语正确的是
A.将NH3通入滴有酚酞的水中,溶液变红:NH3+ H2O  NH3·H2O NH3·H2O   + OH- + OH- |
B.铜与浓硫酸共热产生气体:Cu+H2SO4(浓) Cu2+ + SO42- + H2↑ Cu2+ + SO42- + H2↑ |
| C.CH3COONa的水溶液呈碱性:CH3COO- + H2O = CH3COOH + OH- |
| D.用NaOH溶液吸收Cl2:Cl2+2OH- = 2Cl- + H2O |
下列物质及用途对应不正确的是
| A |
B |
C |
D |
|
| 物质名称 |
氢氧化铝 |
碳酸钠 |
氢氧化钠 |
油脂 |
| 用途 |
做抗酸药 |
去除油污 |
做调味剂 |
制造肥皂 |
下列有关化学用语表示正确的是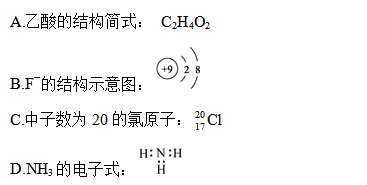
在一定条件下,动植物油脂与醇反应可制备生物柴油,化学方程式如下,下列叙述错误的是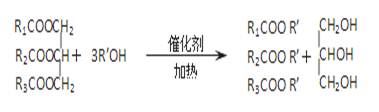
| A.生物柴油由可再生资源制得 |
| B.生物柴油是不同酯组成的混合物 |
| C.动植物油脂是高分子化合物 |
| D.“地沟油”可用于制备生物柴油 |