某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如下图所示。则稀溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为 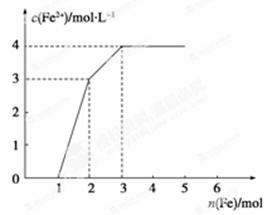
| A.1∶1∶1 | B.1∶3∶1 | C.3∶3∶8 | D.1∶1∶4 |
已知X、Y、Z三种主族元素在周期表中的位置如图所示,设X的原子序数为a。则下列说法不正确的是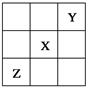
| A.Y与Z的原子序数之和可能为2a | B.Y的原子序数可能为a-17 |
| C.Z的原子序数可能为a+31 | D.X、Y、Z一定为短周期元素 |
在一定温度下,反应1/2H2(g)+1/2 X2(g)  HX(g)的平衡常数为10。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于
HX(g)的平衡常数为10。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于
| A.5% | B.100% | C.25% | D.33% |
短周期主族元素A、B、C、D的原子序数依次增大,A、B、C原子的最外层电子数之和为12,B、C、D位于同一周期,C原子的最外层电子数既是A原子内层电子数的3倍又是B原子最外层电子数的3倍。下列说法正确的是
A.原子半径:B>A,离子半径:C<D B.B的单质能与A的最高价氧化物发生置换反应
C.元素B和D能形成BD2型的共价化合物 D.D的单质有毒,且有漂白性
一定物质的量的Cl2与NaOH溶液反应,所得产物中含NaClO和NaClO3的物质的量之比为3∶5,则参加反应的Cl2与NaOH的物质的量之比为
| A.8∶11 | B.3∶5 | C.1∶2 | D.9∶4 |