下图是某只含有C、H、O、N的有机物简易球棍模型。下列关于该有机物的说法正确的是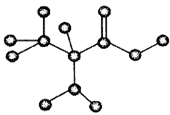
A、分子式为C3H7NO B、在一定条件下,可以生成高分子化合物
C、不能和盐酸溶液反应 D、不能和NaOH溶液反应
一定温度下,可逆反应 A2(g)+3B2(g)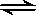 2AB3(g) 达到平衡的标志是
2AB3(g) 达到平衡的标志是
| A.容器内每减少1mol A2,同时生成2mol AB3 |
| B.容器内每减少1mol A2,同时生成3mol B2 |
| C.容器内A2、B2、AB3的物质的量之比为1:3:2 |
| D.容器内A2、B2、AB3的物质的量浓度相等 |
已知在某密闭容器中发生反应 4NH3+5O2=4NO+6H2O,若反应速率分别用
υ(NH3)、υ(O2)、υ(NO)、υ(H2O)表示,则下列关系正确的是
A.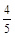 υ(NH3) =υ(O2) υ(NH3) =υ(O2) |
B. υ(O2) =υ(H2O) υ(O2) =υ(H2O) |
C. υ(NH3) =υ(H2O) υ(NH3) =υ(H2O) |
D.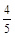 υ(O2) =υ(NO) υ(O2) =υ(NO) |
如图所示,甲、乙、丙、丁分别代表Na2CO3、NaOH、NaHCO3、CO2四种物质,a、b、c、d、e、f分别表示两种物质间的转化关系。对于图中两种物质间的转化,通过一步反应就能实现的有()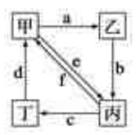
| A.只有a、b、c、d | B.只有a、c、d、e |
| C.只有a、c、d、e、f | D.a、b、c、d、e、f |
某同学对下列四个实验都设计了两种方案。其中,两个方案理论上均可行、且第二方案比第一方案更方便合理的是()
| 实验目的 |
第一方案 |
第二方案 |
|
| A |
除去氯化钙固体中少量氯化铵 |
与熟石灰混合加热 |
直接加热 |
| B |
清洗热水瓶中的水垢 |
用食醋洗涤 |
用洗洁精洗涤 |
| C |
检验亚硫酸钠是否被氧化 |
滴入Ba(OH)2溶液 |
滴入盐酸酸化的BaCl2溶液 |
| D |
区分黄铜(铜锌合金)和黄金 |
测量密度 |
加盐酸,看气泡 |
为研究铁及其化合物的性质,某探究小组进行如下实验:将一表面有铁锈(Fe2O3)的铁钉浸泡在稀硫酸中一段时间,取适量浸泡后的溶液滴入少量KSCN溶液,未见溶液呈血红色。请根据要求回答问题:
(1)甲同学认为:“将一表面有铁锈(Fe2O3)的铁钉浸泡在稀硫酸中一段时间”,体系中不仅铁锈、铁与稀硫酸发生了反应,同时还发生另一个反应。
①铁锈与稀硫酸反应的化学方程式为__________________________。
②“还发生另一个反应”对应的离子方程式应为______________________________。
(2)现有下列仪器和试剂,若要通过实验验证甲同学的分析是否正确,你将设计怎样的实验方案?请将你设计的方案填入下列表格中。
仪器:试管、胶头滴管
试剂:氯水、稀硫酸、铁粉、硫氰酸钾溶液
| 实验操作 |
实验现象 |
实验结论 |
| 取适量铁钉与稀硫酸浸泡后的溶液于试管中,____________________ __________________________。 |
__________________ __________________ _________________。 |
乙同学的观点____________ (填“正确”或“错误”)。 |