下列关于物质性质变化的比较, 不正确的是
| A.酸性强弱: HI > HBr > HCl > HF | B.原子半径大小: Na > S > O |
| C.碱性强弱: KOH > NaOH > LiOH | D.还原性强弱: F- > Cl- > I- |
某些芳香族化合物的分子式为C7H8O,其中与氯化铁溶液混合后能发生显色反应和不发生显色反应的种类分别是
| A.2种和1种 | B.2种和3种 | C.3种和1种 | D.3种和2种 |
下列物质中,发生消去反应生成的烯烃只有一种的是
①2-丁醇②2-甲基-2-丙醇③1-丁醇④2-甲基-2-丁醇
| A.①② | B.②③ | C.②④ | D.③④ |
下列有机化合物分子中的所有碳原子不可能处于同一平面的是
A. |
B. |
C. |
D. |
如图,有机化合物Ⅰ转化为Ⅱ的反应类型是
| A.氧化反应 | B.还原反应 | C.取代反应 | D.水解反应 |
由-CH3、-OH、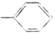 、-COOH四种基团两两组合而成的化合物中,其水解液能使石蕊变红的有
、-COOH四种基团两两组合而成的化合物中,其水解液能使石蕊变红的有
| A.5种 | B.4种 | C.3种 | D.2种 |