比较下列各组微粒半径,正确的是
①Cl<Cl-<Br- ②F-<Mg2+<Al3+ ③Na+<Na<K ④S2-<Cl-<Br-
| A.①和③ | B.只有② | C.只有③ | D.①和④ |
下列各组离子能大量共存的是()
A. 、 、 、 、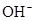 、 、 |
B.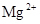 、 、 、 、 、 、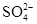 |
C.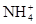 、 、 、 、 、 、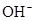 |
D. 、 、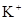 、 、 、 、 |
用NA表示阿伏加德罗常数的值,下列说法正确的是()
| A.标准状况下,11.2 LO2和O3组成的混合气体含有原子数为NA |
| B.常温常压下,1.7 g NH3含有的电子数目为 NA |
| C.0.1mol/LNa2SO4溶液中含有Na+的个数为0.2NA |
| D.常温常压下,22.4 LCO2与足量Na2O2反应转移电子数为 NA |
下列物质中,不属于电解质的是()
| A.CO2 | B.NaCl | C.H2SO4 | D.KOH |
下列反应既属于离子反应,又属于氧化还原反应的是()
A.CaO+H2O= |
B.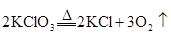 |
C.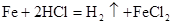 |
D.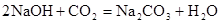 |
下列叙述中正确的是()
A.钠与硫酸铜溶液反应会置换出红色的铜
B.常温下干燥氯气与铁不反应,可以用钢瓶储存液氯
C.CO2、NO2、SO2都能与H2O反应,其反应原理相同
D.C、N、S三种单质直接与O2反应都能生成两种氧化物