A、B、C、D、E是同一周期的五种主族元素,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序是
A. B、A、D、C、E B. E、C、D、B、A
C. A、B、C、D、E D. C、D、A、B、E
α1和α2分别为A、B在两个恒容容器中平衡体系A(g) 2B(g)和2A(g)
2B(g)和2A(g) B(g)的A的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是
B(g)的A的转化率,在温度不变的情况下,均增加A的物质的量,下列判断正确的是
A.α1、α2均减小 B.α1、α2均增大
C.α1减小,α2增大 D.α1增大,α2减小
在密闭容器发生下列反应aA(g) 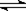 cC(g) + dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g) + dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
| A.A的转化率变大 | B.C的浓度减小 |
| C.D的体积分数变大 | D.a < c+d |
常温下,盐酸和氨水等体积混合后,其溶液的pH恰好等于7,则下列说法中正确的是
| A.盐酸中的c(H+)一定小于氨水中的c(OH-) |
| B.盐酸的物质的量浓度一定小于氨水的物质的量浓度 |
| C.反应后生成的盐溶液一定没有发生水解 |
| D.盐酸中HCl的物质的量一定等于氨水中NH3・H2O的物质的量 |
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s)  NH3(g) + HI(g) ②2HI(g)
NH3(g) + HI(g) ②2HI(g)  H2(g) + I2(g),当反应达到平衡时,c(H2)= 0.25mol/L,c(HI)= 2mol/L,则此温度下反应①的平衡常数为
H2(g) + I2(g),当反应达到平衡时,c(H2)= 0.25mol/L,c(HI)= 2mol/L,则此温度下反应①的平衡常数为
| A.5 | B.6.25 | C.20 | D.25 |
体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2 + O2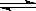 2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
| A.等于p% | B.大于p% | C.小于p% | D.无法判断 |