下列各变化中属于原电池反应的是( )
| A.在空气中金属铝表面迅速氧化形成保护层 |
| B.镀锌铁表面有划损时,也能阻止铁被氧化 |
| C.红热的铁丝与冷水接触,表面形成蓝黑色保护层 |
| D.浓硝酸比稀硝酸更能氧化金属铜 |
能用分液漏斗分离的混合物是()
| A.液溴和四氯化碳 | B.乙醇和乙酸 |
| C.氯化钙和碳酸钠溶液 | D.苯和蒸馏水 |
白藜芦醇结构如下式, 它广泛存在于食物(例如桑椹、花生、尤其是葡萄)中,它可能具有抗癌性。能够与1mol该化合物起反应的Br2或H2的最大用量分别是
| A.6mol,7mol | B.5mol,7mol |
| C.3.5mol,6mol | D.1mol,1mol |
描述CH3—CH=CH—C≡C—CF3分子结构的下列叙述中,正确的是
| A.6个碳原子有可能都在一条直线上 | B.6个碳原子连接起来呈现连续的多个锯齿状 |
| C.6个碳原子一定都在同一平面上 | D.在同一平面上最多可有12个原子 |
某有机物的结构如下式,在以下六种反应类型: ①加成②水解③酯化④氧化⑤中和⑥消去中,它在一定条件下能够发生的反应是
| A.②③④ | B.①③⑤⑥ | C.②③④⑤⑥ | D.①③④⑤ |
某化合物的结构(键线式)及球棍模型如下: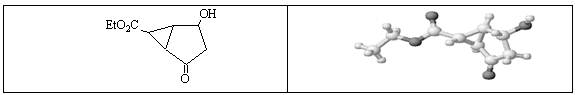
该有机分子的核磁共振波谱图如下(单位是ppm)。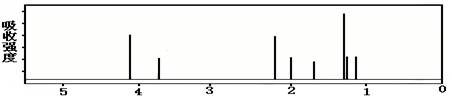
下列关于该有机物的叙述正确的是:
| A.该有机物不同化学环境的氢原子有8种 |
| B.该有机物属于芳香族化合物 |
| C.键线式中的Et代表的基团为-CH3 |
| D.该有机物在一定条件下不能够发生消去反应 |