鸡蛋壳的主要成分是碳酸钙,为了测定蛋壳中碳酸钙的质量分数,小刚和小勇同学进行了如下实验。请回答相关问题:(1)他俩将蛋壳洗净、干燥并捣碎放在烧杯里,然后往烧杯中加入足量盐酸,在蛋壳上很快就有许多小气泡产生,将收集到的气体通入澄清石灰水中,石灰水变浑浊。据此可判断,收集到的气体中含有 。
(2)实验过程和测定的相关实验数据如下所示: 小刚根据“蛋壳残渣质量为4.3g”,求得蛋壳中碳酸钙的质量分数为 ;
小刚根据“蛋壳残渣质量为4.3g”,求得蛋壳中碳酸钙的质量分数为 ;
小勇根据“反应过程中减少的质量”,也求得了蛋壳中碳酸钙的质量分数并计算出了盐酸的溶质质量分数,请你写出小勇的计算过程和结果。
(3)小刚和小勇根据不同的数据求得蛋壳中碳酸钙的质量分数有明显差别,请你分析其中可能的原因。
有3g混有碳酸钠的氯化钠固体样品,向其中滴加盐酸,加入盐酸的质量与生成二氧化碳气体的质量符合图所示的质量关系.(不计损耗)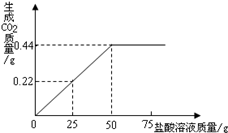
(1)样品完全反应后,共放出二氧化碳气体的物质的量为mol。
(2)计算样品中氯化钠的质量分数。(根据化学方程式列式计算)
为测定某生理盐水的溶质质量分数,现将生理盐水样品与足量的硝酸银溶液混合,相关实验数据如下表所示(不计损耗):
| 反应前 |
反应后 |
||
| 实验 数据 |
生理盐水样品的质量 |
加入硝酸银溶液的质量 |
过滤后剩余溶液的质量 |
| 130 g |
40 g |
167.13 g |
(1)反应后生成氯化银固体的质量为g。
(2)请计算该生理盐水中含氯化钠的物质的量(根据化学方程式列式计算)。
(3)。
一种石灰石样品的成分是CaCO3和SiO2。为了测定该样品中CaCO3的质量分数,现将100g盐酸等分5次加到35g此样品中,得到部分数据与图像。
| 次数 |
第1次 |
第3次 |
第4次 |
| 加入盐酸的质量(g) |
20 |
20 |
20 |
| 剩余固体的质量(g) |
30 |
a |
15 |
(1)石灰石样品中CaCO3的质量分数是。
(2)第3次加入盐酸后,a为g。
(3)反应共产生0.2mol CO2求加入盐酸溶质的质量分数。(根据化学方程式列式计算)
某实验室用30克氯酸钾和5克二氧化锰的混合物加热制取氧气,反应一段时间后,冷却称量,得到25.4g剩余固体物质。试计算:
①生成氧气的物质的量为摩尔。
②参加反应的氯酸钾的物质的量为摩尔。(根据化学方程式列式计算)
为测定某铁粉样品(含少量木炭粉)中铁的含量,往盛有219g稀盐酸的烧杯中不断加入铁粉样品,测得生成氢气质量与所加铁粉样品质量的关系如图的所示。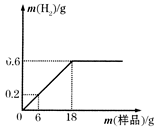
(1)稀盐酸恰好完全反应时,生成氢气的质量为g。
(2)6g铁粉样品中含铁单质的质量为g。
(3)求稀盐酸中溶质的质量分数(写出计算过程)。