(1)下面各个小题已经给出了化学反应的反应物,试写出完整的化学反应方程式并配平:(每小题2分,共6分)
过量乙酸与甘油的酯化反应
蔗糖水解:
CH3CH(OH)CH3的催化氧化:
(2).硫-碘循环分解水制氢主要涉及下列反应:
Ⅰ.SO2+2H2O+I2===H2SO4+2HI Ⅱ.2HI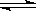 H2+I2 Ⅲ.2H2SO4===2SO2+O2+2H2O
H2+I2 Ⅲ.2H2SO4===2SO2+O2+2H2O
(1)一定温度下,向1L密闭容器中加入1mol HI(g),发生反应Ⅱ,生成的I2为气体,H2物质的量随时间的变化如图所示。0-2 min内的平均反应速率υ(HI)= 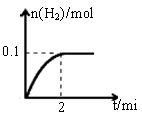
(2)实验室用Zn和硫酸制取H2,为了加快反应速率,下列措施不可行的是 (填序号)
a.加入浓硝酸 b.加入少量CuSO4固体 c.用粗锌代替纯锌
d.加热 e.把锌粒弄成锌粉 f.用98.3%浓硫酸
写出下列各烷烃的分子式。
(1)烷烃A在同温同压下蒸气的密度是H2的36倍___________________。
(2)烷烃B的分子中含有200个氢原子____________________。
已知在下图转化关系(某些转化关系中的产物已略去)中都是中学化学常见的物质,物质A、D、G是单质,磁性黑色物质C是某金属矿物的主要成份,E是一种非氧化性酸,F是混合物,H是极易溶于水的碱性气体。
请回答下列问题:
(1)写出下列物质的化学式:A、C、I
(2)写出反应①的化学方程式:
写出生成混合物F的离子方程式:
(3)在一定温度、压强和有催化剂存在的条件下将l mol G和2,5 mol D放入500mL密闭容器中。经过20min达到平衡,平衡后H的浓度为2mol/L,
①则用G表示20min内的平均反应速率为:____
该温度下此反应的平衡常数K=,D的转化率为
②如果保持温度不变,再向容器中同时充入1.5 mol G和1 mol H,D的转化率将(填“升高”、“不变”或“降低”),再次平衡后H的体积分数为____。
X、Y、Z、M是元素周期表前四周期中的四种常见元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y |
常温常压下,Y单质是黄色固体,常在火山口附近沉积 |
| Z |
Z和Y同周期,Z的电负性大于Y |
| M |
M的一种核素的质量数为63,中子数为34 |
(1)属于主族元素的原子半径从大到小的顺序是(写化学式,下同),Y和Z的最高价氧化物对应的水化物的酸性较强的是,在H-Y、H-Z两种共价键中,键的极性较强的分子是。
(2)XY2是一种常用的溶剂,XY2的电子式是,XY2的分子中存在个σ键。
(3)M位于周期表第____周期第族,M的基态原子核外电子排布式是;M2Y在空气中煅烧生成M2O的化学方程式是。
(4)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y。
已知:XO(g)+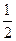 O2(g)= XO2(g)△H =" -283.0" kJ·mol-1
O2(g)= XO2(g)△H =" -283.0" kJ·mol-1
Y(g)+ O2(g)= YO2(g)△H = -296.0 kJ·mol-1
写出此反应的热化学方程式____。
钾是活泼的碱金属,钾和氧有氧化钾(K2O)、过氧化钾(K2O2)和超氧化钾(KO2)等多种化合物.
(1)钾和硝酸钾反应可制得氧化钾K+KNO3→K2O+N2(未配平),每生成9.4gK2O消耗的还原剂有___________g
(2)超氧化钾和过氧化钾都能与二氧化碳反应均生成氧气和K2CO3,在医院、矿井、潜水、高空飞行中用作供氧剂.请尝试写出超氧化钾与二氧化碳反应的化学方程式____________,为了维持封闭环境气压稳定可以使用超氧化钾和过氧化钾的混合物使吸收的CO2与生成的O2体积相同(同温同压),则它们的物质的量之比为______
(3)KO2加热至600℃部分分解得到固态混合物 A.6.30g A充分吸收二氧化碳生成碳酸钾并产生氧气1.12L(标准状况),如果产物A只含有两种化合物,写出所有可能组成的化学式组合,并计算A中两种化合物的物质的量之比.________________________
工业盐中含有NaNO2,外观和食盐相似,有咸味,人若误食会引起中毒,致死量为0.3g—0.5g.已知NaNO2能发生如下反应:aNO +xI—+yH+=bNO↑+cI2+zH2O,
+xI—+yH+=bNO↑+cI2+zH2O,
请回答下列问题:
(1)上述反应中,x、y、z的数值分别是(全对才给分),
(2)根据上述反应,可用化学试纸和生活中常见物质进行实验来鉴别工业盐和食盐,现有碘化钾淀粉试纸,则还需选用的生活中常见物质的名称为.
(3)某工厂废切削液中含有2%—5%的NaNO2,直接排放会造成水污染,但加入下列物质中的某一种就能使NaNO2转化为不引起污染的N2,该物质是,
a.NaCl b.H2O2c.NH4Cl d.浓H2SO4
所发生反应的离子方程式为:.