乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1)CaC2与水反应生成乙炔的化学方程式 ;
CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为 _________________________。
(2)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。
(3)金刚石的晶胞如图所示,已知六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,立方氮化硼晶体密度为ag/cm3,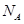 表示阿伏加德罗常数,则立方氮化硼晶胞体积为 cm3。
表示阿伏加德罗常数,则立方氮化硼晶胞体积为 cm3。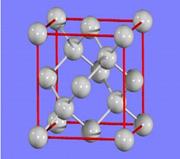
在一定条件下Na2CO3溶液存在水解平衡:CO32-+H2O HCO3-+OH-。下列说法正确的是
HCO3-+OH-。下列说法正确的是
| A.Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+) |
| B.升高温度,溶液的PH值减小 |
| C.稀释溶液,溶液中c(H+)和c(OH-)都减少 |
| D.加入NaOH固体,溶液pH减小 |
物质的量浓度都为0.1mol·L-1的CH3COOH与NaOH溶液等体积混合后,下列关系式不正确的是
| A.[Na+]+[H+]=[OH-]+[CH3COO-] |
| B.[Na+]>[CH3COO-]>[H+]>[OH-] |
| C.[OH-]=[H+]+[CH3COOH] |
| D.[CH3COOH]+[CH3COO-]=[Na+] |
能说明醋酸是弱电解质的是
| A.中和10mL 1mol/L CH3COOH溶液需要10ml 1mol/L NaOH溶液 |
| B.用食醋可以除热水瓶内的水垢 |
| C.pH=2的醋酸溶液稀释1000倍后pH小于5 |
| D.用浓H2SO4和醋酸钠固体共热可制得醋酸 |
下列反应的离子方程式正确的有
| A.NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O |
B.电解饱和食盐水:2Cl-+2H2O H2↑+Cl2↑+2OH- H2↑+Cl2↑+2OH- |
| C.氯气通入冷水中 Cl2 +H2O = Cl-+ClO-+2H+ |
| D.FeBr2溶液中通入足量的Cl2:2Fe2++Cl2=2Fe3++2Cl- |
下列说法正确的是:
| A.95℃时纯水的pH<7,说明加热可以使纯水呈酸性。 |
| B.25℃时,pH=12的某溶液中,由水电离出的c(OH-)一定为1×10-12mol/L。 |
| C.pH=3的醋酸溶液,稀释至10倍后pH=4。 |
| D.实验室通常将固态氯化铁溶解在盐酸中,再稀释到相应浓度来配制FeCl3溶液。 |