下列各组微粒,半径大小比较中错误的是
| A.K >Na >Li | B.Na+>Mg2+>Al3+ |
| C.Mg2+>Na+>F-- | D.Cl-->F-->F |
下列叙述不正确的是( )
| A.化学平衡发生移动,平衡常数不一定发生变化 |
| B.升高温度会增大化学反应速率,其原因是增大了活化分子的百分数 |
C.某化学反应的能量变化如图所示,则该反应的ΔH>0,ΔS>0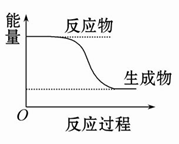 |
D.H3PO4的电离常数:  |
某温度下,可逆反应mA(g)+nB(g) pC(g)+qD(g)平衡常数为K,下列说法正确的是( )
pC(g)+qD(g)平衡常数为K,下列说法正确的是( )
| A.K越大,达到平衡时,反应进行的程度越大 |
| B.K随着温度的升高而增大 |
| C.K越小,达到平衡时,反应物的转化率越大 |
| D.K随反应物浓度的改变而改变 |
下列说法正确的是( )
| A.一定温度下,反应MgCl2(l)=Mg(l)+Cl2(g)的ΔH<0ΔS>0 |
B.水解反应NH4++H2O NH3·H2O+H+达到平衡后,升高温度平衡逆向移动 NH3·H2O+H+达到平衡后,升高温度平衡逆向移动 |
| C.铅蓄电池放电时的负极和充电时的阳极均发生还原反应 |
| D.对于反应2H2O2=2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率 |
同时向五个温度不同、容积相同的恒容密闭容器中,分别加入等量的原料气(SO2和O2),发生反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0。经过相同的反应时间后,分别测定五个容器中SO2的转化率(α),并作出其随反应温度(T)变化的关系图。下列示意图中,不可能与实验结果相符的是( )
2SO3(g) ΔH<0。经过相同的反应时间后,分别测定五个容器中SO2的转化率(α),并作出其随反应温度(T)变化的关系图。下列示意图中,不可能与实验结果相符的是( )
某密闭容器中,可逆反应 L(s)+G(g) 3R(g) ΔH>0,如图表示外界条件温度、压强的变化对上述反应的影响。下列表述正确的是( )
3R(g) ΔH>0,如图表示外界条件温度、压强的变化对上述反应的影响。下列表述正确的是( )
| A.该反应达平衡后加入适当的催化剂可提高G的转化率 |
| B.达到平衡后向容器中加入L,平衡向右移动,G的转化率增大 |
| C.图中的y可能是平衡混合气中G的质量分数 |
| D.图中的y可能是达到平衡时G的转化率 |