已知a、I、e为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子代码 |
a |
I |
e |
| 原子核数 |
单核 |
四核 |
双核 |
| 粒子的电荷数 |
一个单位正电荷 |
0 |
一个单位负电荷 |
物质A由a、e构成,B、C、D、K都是单质,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示: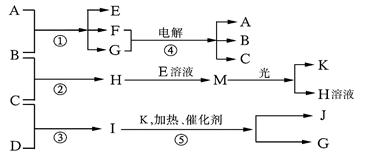
请填写下列空白:
(1)写出下列物质的化学式:B J 。
(2)写出下列反应的离子方程式:
①H+E(溶液)→M 。②I溶于G 。
(3)在通常状况下,若1 g C气体在B气体中燃烧生成H气体时放出92.3 kJ热量,则2 mol H气体完全分解生成C气体和B气体的热化学方程式为 。
聚合硫酸铁又称聚铁, 化学式为[Fe(OH)(SO4)]m, 广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O )过程如下: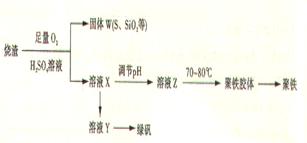
验证固体W焙烧后产生的气体含有SO2的方法是
(2)实验室制备、收集干燥的SO2, 所需仪器如下。装置A产生SO2, 按气流方向连接各仪器接口,顺序为a→___ →___ →___ →___f。装置D的作用是, 装置E中NaOH溶液的作用是。 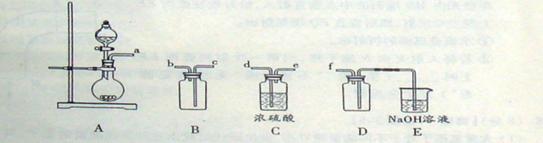
(3)制备绿矾时,向溶液X中加入过量_____,充分反应后,经_______操作得到溶液Y,再经浓缩,结晶等步骤得到绿矾。
(4)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为。若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏_______。
铜、铜的氧化物及铜的氢氧化物都是常用的化学试剂。已知红色的氧化亚铜Cu2O在酸性溶液中发生自身氧化还原反应生成Cu2+和Cu,Cu2O在空气中灼烧生成CuO。含有醛基的有机物与新制的氢氧化铜共热会出现Cu2O红色沉淀,某化学兴趣小组对此提出质疑,认为红色沉淀还可能是Cu2O和Cu的混合物,为了验证上述猜测,他们设计了如下三个方案:
| 方案甲 |
取该红色沉淀溶于稀硫酸中,观察是否有残渣。 |
| 方案乙 |
取该红色沉淀溶于稀硝酸中,观察溶液颜色。 |
| 方案丙 |
称取红色沉淀a g,在空气中充分灼烧至完全变黑,并在干燥器中冷却,再称重,反复多次直到固体恒重称的固体质量为b g,比较a和b的关系。 |
(1)如果红色沉淀是Cu2O和Cu的混合物,按上述方案乙进行实验,写出可能发生反应的化学方程式;
(2)上述三个方案中,你认为最合理的是,实施该实验方案能说明红色沉淀仅是Cu2O的依据是;
(3)小林同学针对上述质疑,提出新的试验方案并组装出下列实验装置,根据实验前后红色样品质量比较验证上述猜测。进行该实验时,称量装有红色样品的双通管并连接各仪器之后,点燃酒精灯前,应进行的实验操作是。
海洋植物如海带海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实 验室里从海藻中提取碘的流程如下:
(1)指出提取过程中有关实验操作的名称:①;③;
(2)操作③用到的主要玻璃仪器
(3)提取碘的过程中,可供选择的有机溶剂是(填选项字母)__________。
| A.水、酒精 | B.四氯化碳、苯 | C.汽油、醋酸 | D.汽油、酒精 |
(4)写出②的离子方程式:
(5)能选用汽油从碘水中提取碘的原因是_______________
A、B、C、D、E五种常见化合物,都是由下面中的离子形成的:阳离子:K+、Na+、Al3+、Fe3+阴离子:HCO3—、SO42—、OH-、 Cl—
为了鉴别上述化合物,分别完成以下实验,其结果是:
① 将它们溶于水后,A为棕黄色溶液,其他均为无色溶液;
② 将它们进行焰色反应,仅有C、E为紫色(透过蓝色钴玻璃);
③ 将B溶液滴人到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
④ 在各溶液中加入硝酸钡溶液,再加过量稀硝酸,只有D中放出无色气体,只有A、C中产生白色沉淀;
⑤ 将A、E两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出的化学式:A____,C。
(2)写出B和D反应的离子方程式。
(3)进行焰色反应实验操作时,使用铂丝前应该用________洗涤。
(4)在D溶液中加入少量澄清石灰水,其离子方程式为____
(5)向100mL 1mol/L C溶液中加入0.2 molBa(OH)2溶液,充分反应后得到溶质是
将一只铝制的易拉罐内充满二氧化碳,然后往罐内注入足量的NaOH溶液,立即用胶布密封罐口,经过一段时间后,罐壁凹瘪,又过一段时间后,瘪了的罐壁重新鼓起来。
(1)罐壁凹瘪的原因是;
反应的化学方程式是。
(2) 瘪罐重新鼓起来的原因是;
反应的离子方程式是。