常温下Ca(OH)2溶于水达饱和时存在如下平衡: Ca(OH)2(s)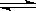 Ca(OH)2(aq),
Ca(OH)2(aq),
Ca(OH)2(aq)==Ca2++2OH— 饱和石灰水的密度为d g/cm3,溶液的pH=12。则该温度下Ca(OH)2的溶解度为 ( )
A.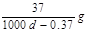 |
B.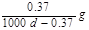 |
C.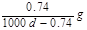 |
D.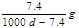 |
用食用白醋(醋酸浓度约1mol•L-1)进行下列实验,能证明醋酸为弱电解质的是
| A.白醋中滴入石蕊试液呈红色 |
| B.白醋能溶解氢氧化铜 |
| C.蛋壳浸泡在白醋中有气体放出 |
| D.pH试纸显示白醋的pH为2~3 |
把A、B、C、D四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若A、B相连A为负极;C、D相连D上有气泡逸出;A、C相连A 被腐蚀;B、D相连,B被保护。则四种金属的活泼性顺序由大到小排列为
A.A>B>C>D B.A>C>B>D
C.A>C>D>B D.B>D>C>A
下列说法正确的是
| A.强电解质溶液的导电能力一定比弱电解质溶液的强 |
B.一定温度下,可逆反应2X (g)+Y (g)  2Z (g)达到平衡的标志是:容器内X、Y、Z的物质的量之比为2:1:2 2Z (g)达到平衡的标志是:容器内X、Y、Z的物质的量之比为2:1:2 |
| C.升高温度,AgCl的溶解度增大,Ksp增大 |
| D.FeCl3、KAl(SO4)2、Na2CO3的水溶液均显酸性 |
已知25℃、101 kPa下,金刚石、石墨燃烧的热化学方程式分别为:
C(石墨,s)+O2(g)="==" CO2(g)△H=-393.51 kJ• mol-1
C(金刚石,s)+O2(g)="==" CO2(g)△H=-395.41 kJ• moL-1
据此判断,下列说法正确的是
| A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低 |
| B.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低 |
| C.由石墨制备金刚石是吸热反应;金刚石比石墨稳定 |
| D.由石墨制备金刚石是放热反应;石墨比金刚石稳定 |
化学反应N2+3H2 2NH3的能量变化如下图所示,该反应的热化学方程式是
2NH3的能量变化如下图所示,该反应的热化学方程式是
A.N2(g)+3H2(g) 2NH3(1) △H=2(a-b-c)kJ·mol-1 2NH3(1) △H=2(a-b-c)kJ·mol-1 |
B.N2(g)+3H2(g) 2NH3(g) △H=2(b-a)kJ·mol-1 2NH3(g) △H=2(b-a)kJ·mol-1 |
C.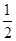 N2(g)+ N2(g)+ H2(g) H2(g)  NH3(1) △H=(b+c-a)kJ·mol-1 NH3(1) △H=(b+c-a)kJ·mol-1 |
D.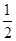 N2(g)+ N2(g)+ H2(g) H2(g) NH3(g) △H=(a+b)kJ·mol-1 NH3(g) △H=(a+b)kJ·mol-1 |