向某溶液中加入BaCl2溶液,再加入稀硝酸,产生的白色沉淀不消失,下列叙述正确的是
A.溶液中一定含有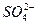 |
| B.溶液中一定含有Ag+ |
C.溶液中一定含有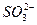 |
D.溶液中可能含有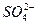 、 、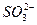 、Ag+中的某一种、两种或三种 、Ag+中的某一种、两种或三种 |
据报道,科学家已成功合成了少量N4,有关N4的说法正确的是
| A.N4是N2的同素异形体 |
| B.N4和N2的相对分子质量相同 |
| C.相同质量的N4和N2所含原子个数比为1∶2 |
| D.N4的摩尔质量是56 g |
某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体。现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色。对于原混合气体成分的判断正确的是
| A.肯定有SO2和NO |
| B.肯定没有Cl2、O2和NO2 |
| C.可能有Cl2和O2 |
| D.肯定只有NO |
硫代硫酸钠可用作脱氯剂,已知25.0 mL 0.10 mol·L-1 Na2S2O3溶液恰好把标准状况下112 mL Cl2完全转化为Cl-,则 将转化成
将转化成
| A.S2- | B.S | C. |
D. |
如图,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压滴管,使Y滴入瓶中,振荡,过一会可见小气球a鼓起,气体X和液体Y不可能是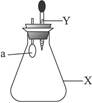
| A.X是NH3,Y是水 |
| B.X是SO2,Y是NaOH浓溶液 |
| C.X是CO2,Y是稀硫酸 |
| D.X是HCl,Y是NaOH稀溶液 |