为了鉴定卤代烃中所含有的卤素原子,现有下列实验操作步骤。正确的顺序是( )
①加入AgNO3 ②加入少许卤代烃试样 ③加热 ④加入5ml 4mol/LNaOH溶液
⑤加入5ml 4mol/LHNO3溶液
| A.②④③① | B.②④③⑤① | C.②⑤③①④ | D.②⑤①③④ |
下列物质的保存方法正确的是()
| A.氢氟酸保存在用塑料塞的玻璃瓶中 |
| B.液溴盛放在用橡皮塞的玻璃瓶中 |
| C.氯水贮存于棕色试剂瓶中,密闭保存于阴凉处 |
| D.漂白粉密封保存于阴凉处 |
下列各组溶液中,可用溴水作试剂将其鉴别出来的是()
| A.汽油、酒精、NaCl溶液 |
| B.汽油、四氯化碳、水 |
| C.汽油、酒精、NaOH溶液 |
| D.汽油、苯、NaOH溶液 |
为实现消除碘缺乏病的目标,卫生部规定食盐必须加碘,其中碘以碘酸钾(KIO3)的形式存在。已知在溶液中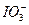 可与I-发生反应:
可与I-发生反应: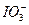 +5I-+6H+====3I2+3H2O
+5I-+6H+====3I2+3H2O
根据此反应,可用试纸和一些生活中常见的物质进行实验,证明食盐中存在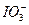 。可供选用的物质有:①自来水,②蓝色石蕊试纸,③碘化钾淀粉试纸,④淀粉,⑤食糖,⑥食醋,⑦白酒。进行上述实验时必须使用的物质是( )
。可供选用的物质有:①自来水,②蓝色石蕊试纸,③碘化钾淀粉试纸,④淀粉,⑤食糖,⑥食醋,⑦白酒。进行上述实验时必须使用的物质是( )
| A.①③ | B.③⑥ | C.②④⑥ | D.①②④⑤⑦ |
向NaBr、NaI、Na2SO3混合液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是( )
| A.NaCl Na2SO4 | B.NaCl NaBr |
| C.NaCl Na2SO4 I2 | D.NaCl NaI Na2SO4 |
已知NaCN溶液呈碱性;(CN)2与卤素单质的性质相似;CN-的还原性介于Br-、I-之间。下列反应不能发生的是( )
A.HCN H++CN- H++CN- |
B.(CN)2+C2H4 NC—CH2—CH2—CN NC—CH2—CH2—CN |
| C.(CN)2+2Br-====2CN-+Br2 |
| D.(CN)2+2OH-====CN-+OCN-+H2O |