下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是 ( )
| A.SO2和SiO2 | B.CO2和H2S | C.NaCl和HCl | D.CCl4和KCl |
在化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况,下列反应中属于这种情况的是
①过量的Zn与18 mo1/L硫酸溶液反应;②过量的氢气与少量的氮气在催化剂存在一定条件下充分反应;③过量的水与一定量氯气;④过量的铜与浓硫酸;⑤过量的铜与稀硝酸;⑥过量的稀硫酸与块状石灰石;⑦常温下过量浓硫酸与铝
| A.②③⑤ | B.②③④⑥⑦ | C.①④⑤ | D.①②③④⑤ |
把甲、乙、丙、丁四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若甲、乙相连,甲的质量减少;丙、丁相连,丁上有气泡逸出;甲、丙相连,甲上发生氧化反应;乙、丁相连,乙是电子流入的一极。则四种金属的活泼性顺序由大到小排列为
| A.甲>乙>丙>丁 | B.甲>丙>乙>丁 |
| C.甲>丙>丁>乙 | D.乙>丁>丙>甲 |
右图各个装置中能组成原电池的是: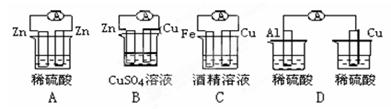
对于100mL 1mol/L盐酸与锌粒的反应,采取下列措施能使反应速率加快的是①升高温度;②改用100mL 3mol/L盐酸;③改用300mL 1mol/L盐酸;④用等量锌粉代替锌粒;⑤滴入少量CuSO4溶液
| A.①②④⑤ | B.①③④⑤ | C.①②③④ | D.①②④ |
若NA表示阿伏加德罗常数,下列说法正确的是
| A.在标准状况下,NA个水分子所占的体积约为22.4L |
| B.5.6g铁与氯气完全反应,失去电子的数目为0.2NA |
| C.1 mol C12发生化学反应,转移的电子数必为2NA |
| D.在标准状况下,22.4L由N2、N2O组成的混合气体中所含有的N的物质的量为2mol |