某温度下,将C12通入NaOH 溶液中,反应得到NaCl、NaClO、NaClO3的混合液。经测定C1O-与ClO3-的浓度之比1:3,则C12与NaOH溶液反应时,被还原的氯元素与被氧化的氯元素的物质的量之比为 ( )
| A.21:5 | B.11:3 | C.3:1 | D.4:l |
下列有关热化学方程式的叙述正确的是
| A.在稀溶液中:H+(aq)+OH-(aq) ="=" H2O(l) ΔH=-57.3 kJ/mol,若将含0.6 mol H2SO4的稀硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ |
| B.已知C(石墨,s)==C(金刚石,s) ΔH>0,则金刚石比石墨稳定 |
| C.需要加热的反应说明它是吸热反应 |
| D.已知2C(s)+2O2(g)==2CO2(g) ΔH1;2C(s)+O2(g)=="2CO(g)" ΔH2,则ΔH1>ΔH2 |
乙烯催化氧化成乙醛可设计成如下图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2 + O2→ 2CH3CHO。下列有关说法正确的是
| A.该电池为可充电电池 |
| B.电子移动方向:电极a→磷酸溶液→电极b |
| C.正极反应式为:CH2=CH2-2e- + 2OH- → CH3CHO + H2O |
| D.每有0.1mol O2反应,则迁移H+ 0.4mol |
下列图示与对应的叙述相符的是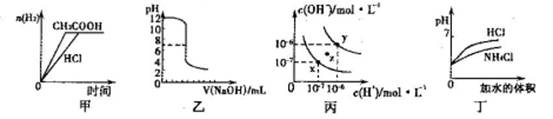
| A.甲图曲线表示向等体积、等物质的量浓度的盐酸和醋酸溶液中分别加人足量镁粉产生H2的物质的量的变化 |
| B.乙表示将0.01mol·L-lNaOH溶液滴人到稀盐酸中的滴定曲线 |
| C.丙为水的电离曲线,从z点到x点,可采用在水中加入适量NaOH固体的方法 |
| D.丁中曲线表示将pH相同的NH4C1溶液和盐酸稀释相同倍数时,二者pH的变化 |
下列实验装置或操作设计正确且能达到实验目的的是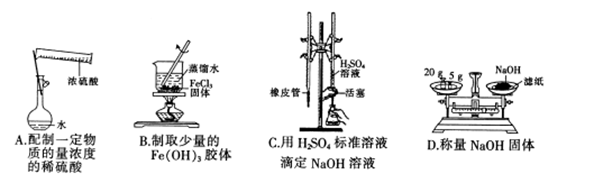
下列各组物质相互混合反应后,最终有白色沉淀生成的是
①金属钠投入到FeCl3溶液中②过量Ba(OH)2溶液和明矾溶液混合
③少量Ca(OH)2投入过量NaHCO3溶液中④向NaAlO2溶液中通入过量CO2
⑤向饱和Na2CO3溶液中通入足量CO2
| A.只有②③④⑤ | B.只有①②⑤ | C.只有②③⑤ | D.全部 |