对于在一定条件下进行的可逆反应:2SO2+O2 2SO3,改变下列条件,可以提高反应物中活化分子百分数,但不改变SO2的转化率的是( )
2SO3,改变下列条件,可以提高反应物中活化分子百分数,但不改变SO2的转化率的是( )
| A.升高温度 | B.增大压强 |
| C.使用催化剂 | D.增大反应物浓度 |
向一定体积含HC1、H2SO4、NH4NO3、A1C13的混合溶液中逐滴加入Ba(OH)2溶液,溶液中产生沉淀的物质的量与加入Ba(OH)2溶液的体积关系正确的是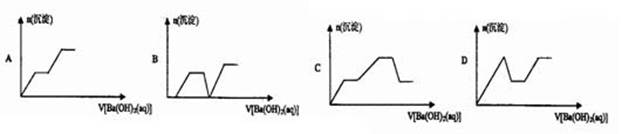
向含有Fe2+、Al3+、NH4+、Na+、K+的溶液中加入过量的Na2O2固体,微热溶液使其充分反应,再通入过量的HCl气体,则反应后溶液中离子浓度大量减小的是
| A.Na+和K+ | B.Al3+和Na+ |
| C.Fe2+和NH4+ | D.Fe2+和K+ |
某溶液可能含Cl-、CO32-、SO42-、Na+,现取少量溶液滴入硝酸酸化,无明显现象,再滴入氯化钡溶液,有白色沉淀生成,取上层清液滴加硝酸银溶液,产生白色沉淀。下列判断不合理的是
| A.一定有Cl- | B.一定有Na+ |
| C.一定无CO32- | D.一定有SO42- |
某学习小组进行了下图所示的实验,实验后组员之间的交流不合理的是
| A.甲同学认为试管b中收集到的气体可点燃,且产生淡蓝色火焰 |
| B.乙同学认为试管a中生成的黑色固体可能为四氧化三铁 |
| C.丙同学认为可用盐酸和KSCN溶液来验证产物中的三价铁 |
| D.丁同学认为将少量还原性铁粉放入试管中,加适量的水,加热也可实现该反应 |
实验室中,要使AlCl3溶液中的Al3+全部沉淀出来,最适宜用的试剂是
| A.NaOH溶液 | B.Ba(OH)2溶液 | C.盐酸 | D.氨水 |