设NA 代表阿伏加德罗常数,下列叙述正确的是
| A.0.1 mol/L NaHCO3和0.1 mol/L Na2CO3混合溶液1L, HCO3-,CO32-的总数为0.2NA |
| B.向密闭容器中充入2molN2和3molH2 ,在一定条件下发生反应,达到平衡时,混合气体中NH3的体积分数为23.45%,则H2和NH3所含的H原子总数为6NA |
| C.若1L0.1 mol/L的CH3COOH溶液含CH3COO-数为aNA, 则1L0.3 mol/L的CH3COOH溶液含CH3COO-数小于0.3aNA |
D.反应N2+3H2 2NH3达平衡时,每形成6NA个N-H键,也生成14克N2 2NH3达平衡时,每形成6NA个N-H键,也生成14克N2 |
| A.①④ | B.①③ | C.②④ | D.②③ |
| A.Na+、NH4+、SO42-、NO3- | B.Fe3+、Mg2+、Cl-、SO42- |
| C.Na+、K+、Cl-、SO42- | D.K+、Na+、A1O2-、MnO4- |
错误的是
| A.电池负极(锌筒)的电极反应式为:Zn-2e-=Zn2+ |
| B.电池正极(石墨)的电极反应式为:2MnO2+2NH4++2e-=Mn2O3+2NH3+H2O |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
| A.标准状况下,由5.6LNO和5.6LO2组成的混合气体中原子总数约为6.02 ×1023 |
| B.50mL0.1mol/LNaC1溶液中,微粒总数约为6.02 × 1021 |
| C.1mol甲基中电子总数约为6.02×1024 |
| D.22.4L乙炔中共用电子对总数约为1.806 ×1024 |
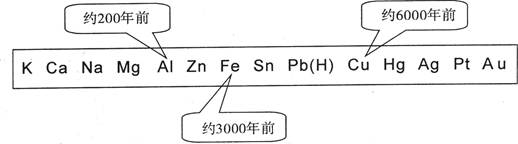
| A.金属的化合价高低 | B.金属的活动性大小 |
| C.金属的导电性强弱 | D.金属在地壳中的含量多少 |