常温下,取pH=2的两种二元酸H2A与H2B各1 mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是 ( )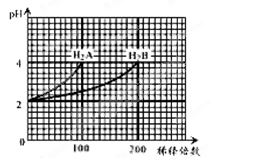
A.H2A的电离方程式为H2A===H++HA-,HA-  H++A2-
H++A2-
B.pH=4的NaHA水溶液中离子浓度大小为c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)
C.含NaHA、NaHB的混合液离子浓度大小为c(Na+)=c(A2-)+c(HB-)+c(H2B)+c(B2-)
D.Na2B的水溶液中,离子浓度大小为c(Na+)>c(B2-)>c(OH-)>c(H+)
下列物质溶于水时会破坏水的电离平衡,且属于电解质的是()
| A.氯气 | B.二氧化碳 | C.碘化钾 | D.醋酸钠 |
目前有研究表明,过氧乙酸对甲型H1N1流感病毒有较好的杀菌作用,这主要是利用了过氧乙酸的()
| A.酸性 | B.强氧化性 | C.还原性 | D.挥发性 |
相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH较大,则同温同体积同浓度的HCN和HClO以及同温同体积同浓度的NaCN和NaClO,下列说法正确的是:
| A.影响水的电离平衡程度:NaCN>NaClO |
| B.与NaOH恰好完全反应时,消耗NaOH的物质的量:HClO > HCN |
| C.pH: HClO >HCN |
| D.电离程度:HCN>HClO |
下列各反应的离子方程式书写正确的是
| A.过氧化钠与水反应:O22−+ 2H2O = O2↑+ 4OH− |
| B.将氯气通入氯化亚铁溶液中:Fe2+ + Cl2 = 2Cl− + Fe3+ |
| C.氯气与水反应:Cl2+ H2O = 2H++ Cl−+ ClO− |
| D.氨水中滴加盐酸:H+ + NH3·H2O = NH4+ + H2O |
用标准浓度的盐酸滴定未知浓度的NaOH溶液,下列各操作(其他操作正确)中会造成测定结果偏低的是
| A.酸式滴定管尖嘴部分有气泡,滴定后消失 |
| B.滴定终点读数时俯视读数 |
| C.用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定 |
| D.锥形瓶水洗后未干燥 |