某探究小组利用丙酮的溴代反应:(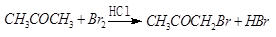 )
)
来研究反应物浓度与反应速率的关系。反应速率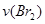 通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
| 实验 序号 |
初始浓度c/mol·l-1 |
溴颜色消失 所需时间t/s |
||
| CH3CO CH3 |
HCl |
Br2 |
||
| ① ② ③ ④ |
0.80 1.60 0.80 0.80 |
0.20 0.20 0.40 0.20 |
0.0010 0.0010 0.0010 0.0020 |
290 145 145 580 |

 分析实验数据所得出的结论不正确的是( )
分析实验数据所得出的结论不正确的是( )
A. 增大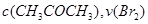 减小 B. 实验②和③的
减小 B. 实验②和③的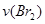 相等
相等 C. 增大
C. 增大
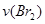 增大 D. 增大
增大 D. 增大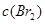 ,
,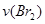 减小
减小
下列说法正确的是
| A.SiO2晶体易溶于水,水溶液呈现酸性 |
| B.CO2通入水玻璃中可以得到硅酸 |
| C.SiO2是酸性氧化物,它不溶于任何酸 |
| D.高温时SiO2可和Na2CO3反应放出CO2,是制造玻璃的反应之一,生成的Na2SiO3是玻璃成分之一 |
下列方法中不能鉴别出NaC1溶液与K2CO3溶液的是
| A.滴加稀盐酸 | B.滴加Ca(OH)2溶液 | C.加热 | D.焰色反应 |
甲烷、乙烯、苯、乙醇是四种常见的有机物,下列关于他们的性质说法中正确的是
| A.这四种有机化合物都是烃 |
| B.乙烯是一种重要的化工原料,可以用于合成乙醇 |
| C.苯分子中含有不饱和键,因此它与乙烯的性质相似,能使酸性高锰酸钾溶液褪色 |
| D.这四种有机化合物都能燃烧,燃烧产物都是二氧化碳和水,且甲烷燃烧时有浓烟 |
某些疾病与相应营养物质的缺乏有关,对应关系正确的一组是
①维生素C:败血病 ②铁元素:贫血症 ③钙元素:骨质疏松
④葡萄糖:低血糖 ⑤碘元素:高血压 ⑥油脂:夜盲症
| A.①⑥ | B.①②③④ | C.①③④⑤ | D.①②③④⑤ |
下列实验不能达到目的的是
| A.除去乙酸乙酯中少量乙酸:加入乙醇和浓硫酸,使乙酸转化为乙酸乙酯 |
| B.除去氯气中的水蒸气:将气体通过装有浓硫酸的洗气瓶 |
| C.海水淡化:将海水进行蒸馏 |
| D.提取溶解在水中的少量碘:加入四氯化碳振荡、静置、分层后取出有机层再分离 |