在同温同压下,某有机物和过量Na反应得到V1 L氢气,另一份等量的该有机物和足量的NaHCO3反应得到V2 L二氧化碳,若V1=V2≠0,则该有机物可能是 ( )
C.HOCH2CH2OH D.CH3COOH
在宾馆、办公楼等公共场所,常使用一种电离式烟雾报警器,其主体是一个放有镅-241(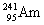 )放射源的电离室。
)放射源的电离室。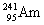 原子核内中子数与核外电子数之差是
原子核内中子数与核外电子数之差是
| A.241 | B.146 | C.95 | D.51 |
目前我们手里把玩的许多新奇电子设备,都是由一些自然界含量稀少的稀有元素提供电能的。下列4种元素中,常用于手机电池的稀有金属元素是
| A.硫 | B.碲 | C.锂 | D.钠 |
下列说法中正确的是
| A.用完的电池可以随意丢弃 |
| B.增加炼铁高炉的高度可以降低尾气中CO的含量 |
| C.无论加入正催化剂还是加入负催化剂都能大大提高化学反应速率 |
| D.把煤粉碎了再燃烧可以提高煤的燃烧效率 |
19世纪中叶,门捷列夫的突出贡献是
| A.提出原子学说 | B.发现元素周期律 |
| C.提出分子学说 | D.发现氧气 |
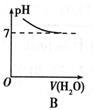
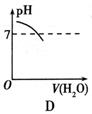
如图所示,能表示人体大量喝水时,胃液的pH变化的图像是