下列反应的热量变化方式与其它三个不相同的是
| A.铝粉与氧化铁的反应 | B.氯化铵与消石灰的反应 |
| C.锌片与稀硫酸反应 | D.钠与冷水反应 |
下列叙述正确的是
| A.1molNaOH的摩尔质量为40g |
| B.0.5molCO2约含有3.01×1023个CO2分子 |
| C.1molN2的体积为22.4L |
| D.1mol物质含有的微粒数就是6.02×1023 |
下列表述正确的是
| A.H2、D2、T2互为同位素 |
| B.金属氧化物均为碱性氧化物 |
| C.质量数为131,中子数为78的碘原子常用于核反应堆的燃料棒.其核外电子数为53 |
D.S2﹣的结构示意图: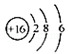 |
下列实验操作或装置正确的是



| A.点燃酒精灯 | B.蒸馏 | C.过滤 | D.稀释浓硫酸 |
元素的种类和原子的种类相比较
| A.前者多 | B.后者多 | C.相等 | D.不能确定 |
下列操作中,一定不需要加热的是
| A.萃取 | B.蒸馏 | C.蒸发 | D.溶解 |