把SO2通入Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。上述一系列过程中,最终被还原的是
| A.SO2 | B.Cl- | C.Fe3+ | D.NO |
根据下图,下列判断中正确的是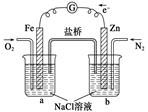
| A.烧杯a中的溶液pH升高 |
| B.烧杯a中发生的反应为2H2O+2e-=H2↑+2OH- |
| C.烧杯b中发生还原反应 |
| D.烧杯b中发生的反应为2Cl--2e-=Cl2↑ |
下列热化学方程式书写正确的是(ΔH的绝对值均正确)
A.C(s)+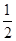 O2(g)=CO(g) ΔH=-110.5kJ·mol-1 (燃烧热) O2(g)=CO(g) ΔH=-110.5kJ·mol-1 (燃烧热) |
| B.2H2O(g)=2H2(g)+O2(g) ΔH=+483.6 kJ·mol-1(反应热) |
| C.C2H5OH+3O2=2CO2+3H2O ΔH=-1368.8 kJ·mol-1(反应热) |
| D.2NaOH(aq)+H2SO4(aq)=Na2SO4 (aq)+2H2O(l) ΔH=-114.6 kJ·mol-1(中和热) |
下列不属于农药污染综合治理措施的是
| A.研制低毒、低残留农药 | B.改进农药使用方法,控制一次使用量 |
| C.禁止在农田中使用农药 | D.综合防治植物病虫,减少农药用量 |
家用洗涤剂是污水中磷元素的重要来源(洗涤剂中常含有三聚磷酸钠),必须采取有效措施控制磷元素大量进入水体,其原因是
| A.使水体酸度大大增加,腐蚀桥梁、闸门等设备 |
| B.磷酸根进入水体,形成多种不溶性的磷酸盐,再吸附杂质,日积月累,使河床抬高造成水患 |
| C.浮游生物得到养分,大量繁殖,死亡后腐败耗尽水中氧,使水质恶化 |
| D.磷酸盐有毒、致癌,不能进入水体 |
“白色污染”的主要危害是:
①破坏土壤结构 ②降低土壤肥效 ③污染地下水 ④危及海洋生物的生存
| A.①② | B.②③ | C.①②③④ | D.②④ |