将一定质量的Ag2SO4固体置于容积不变的密闭容器中(加入少量V2O5),在某温度时发生下列反应:Ag2SO4(s) Ag2O(s)+SO3(g),2SO3(g)
Ag2O(s)+SO3(g),2SO3(g) 2SO2(g)+O2(g)。10min后反应达到平衡,此时c(SO3)为0.4mol·L-1、c(SO2)为0.1mol·L-1,则下列叙述中不正确的是( )
2SO2(g)+O2(g)。10min后反应达到平衡,此时c(SO3)为0.4mol·L-1、c(SO2)为0.1mol·L-1,则下列叙述中不正确的是( )
| A.SO3的分解率为20% |
| B.容器内气体的密度为40g/L |
| C.达到平衡时分解的Ag2SO4固体为0.5mol |
| D.10min内用O2表示的该反应的反应速率为0.005mol/(L·min) |
已知水的电离方程式:H2O 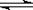 H++ OH-。下列叙述中,正确的是
H++ OH-。下列叙述中,正确的是
| A.升高温度,KW增大,pH不变 |
| B.向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低 |
| C.向水中加入少量硫酸,c(H+)增大,KW不变 |
| D.向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低 |
下列反应一定属于氧化反应的是
| A.失电子的反应 | B.原电池的正极反应 |
| C.放热反应 | D.电镀池镀件一极的反应 |
已知某温度时CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol/L CH3COOH溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。
下列说法中正确的是
| A.a点表示溶液中c(CH3COO-)约为10-3 mol/L |
| B.b点表示的溶液中c(Na+)>c(CH3COO-) |
| C.c点表示CH3COOH和NaOH恰好反应完全 |
D.d点表示的溶液中 大于K 大于K |
研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl===Na2Mn5O10+2AgCl
下列“水”电池在海水中放电时的有关说法正确的是
| A.正极反应式:Ag+Cl--e-===AgCl |
| B.每生成1 mol Na2Mn5O10转移2 mol电子 |
| C.Na+不断向“水”电池的负极移动 |
| D.AgCl是还原产物 |
下列离子方程式中,书写正确的是
A.弱酸酸式盐NaHB在水溶液中水解:HB–+H2O H3O++B2– H3O++B2– |
B.电解盐酸:2C1-+2H2O H2↑+Cl2↑+2OH- H2↑+Cl2↑+2OH- |
| C.氢氧燃料电池在碱性介质中的正极反应式:O2+2H2O+4e一=4OH- |
D.NaHCO3的电离2:NaHCO3 Na++HCO3- Na++HCO3- |