(10分)已知A、B、C、D、E是短周期的5种元素,它们的原子序数依次增大。A元素原子形成的离子核外电子数为零;C、D、E三种元素的最高价氧化物对应水化物之间可以两两反应;A与C同主族;B与E同主族;E的单质为黄色晶体,易溶于二硫化碳。
(1)请写出B、D元素的名称:B ,D 。
(2)画出C元素的离子结构示意图 。
(3)写出D的单质与C的最高价氧化物对应水化物之间反应的离子方程式
(4)A、B、C三种元素形成的化合物所含的化学键类型为 。
(5)B、C、D三种元素的离子半径由大到小的排列顺序为 (用离子符号表示)。
汽车尾气是造成大气污染的主要原因之一,在汽车排气管上安装“催化转换器”使汽车的尾气转换成无毒气体是目前最有效的手段之一。如果用 表示碳原子,用
表示碳原子,用 表示氧原子,用
表示氧原子,用 表示氮原子,如图为气体转换的微观过程。请你根据图示回答下列问题:
表示氮原子,如图为气体转换的微观过程。请你根据图示回答下列问题: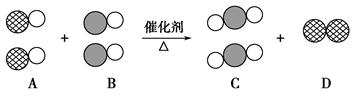
(1)A、B、C三种物质可以归为一类的依据是。
(2)将C归为化合物,将D归为单质的理由是。
(3)用化学反应方程式表示为。
化学变化过程中消耗的A物质和生成的C物质的质量比为。
(4)从微观的角度去描述你获得的关于化学变化的有关信息(答出一条即可)。
已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:
(1)该“84消毒液”的物质的量浓度约为mol·L-1。
(2)某同学取100 mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=mol·L-1。
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为25%的消毒液。下列说法正确的是(填序号)。
| A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器 |
| B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制 |
| C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低 |
| D.需要称量NaClO固体的质量为143.0 g |

(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84 g·cm-3)的浓硫酸配制2 000 mL 2.3 mol·L-1的稀硫酸用于增强“84消毒液”的消毒能力。
①所配制的稀硫酸中,H+的物质的量浓度为mol·L-1。
②需用浓硫酸的体积为mL。
(Ⅰ)下列操作会导致实验结果偏高的是。
A.配制一定物质的量浓度的硫酸溶液时,定容摇匀后,发现液面低于刻度线
B.在配制一定物质的量浓度溶液时,用10 mL的量筒量取5.0 mL液体溶质时俯视读数
C.用天平称量20.5 g某物质,砝码和药品的位置放反,所得药品的质量
D.配制一定物质的量浓度的溶液时,定容时俯视读数,所得溶液的浓度
(Ⅱ)现有下列仪器或用品:
a铁架台(含铁圈、铁夹);b锥形瓶;c滴定管;d烧杯(若干);e玻璃棒;f胶头滴管;g托盘天平(含砝码);h滤纸;i量筒;j漏斗;k温度计
现有下列试剂:
A.NaOH固体B.碳酸钠溶液
C.氯化镁溶液 D.蒸馏水
试填空:
(1)如图分别是温度计、量筒、滴定管的一部分,下述判断及读数(虚线刻度)不正确的是。
A.①是量筒,读数为1.5 mL
B.②是量筒,读数为2.50 mL
C.③是滴定管,读数为2.50 mL
D.①是温度计,读数是1.50 ℃
(2)配制100 mL 0.1 mol·L-1的氢氧化钠溶液时,还缺少的仪器有。
(3)除去Mg(OH)2中混有的少量Ca(OH)2,可以用到的试剂是(选填序号),操作方法是、、洗涤。
完成上述操作,上述仪器或用品用到的有(从上述仪器或用品中选择,填上相应序号)。
用质量分数为36.5%的浓盐酸(密度为1.16 g·cm-3)配制成1 mol·L-1的稀盐酸。现实验室仅需要这种盐酸220 mL,试回答下列问题:
(1)配制稀盐酸时,应选用容量为mL的容量瓶。
(2)经计算需要mL浓盐酸,在量取时宜选用下列量筒中的。
| A.5 mL | B.10 mL | C.25 mL | D.50 mL |
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入250 mL容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2 cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)。
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度是(填“偏高”、“偏低”或“无影响”)。若未用蒸馏水洗涤烧杯内壁和玻璃棒或未将洗涤液注入容量瓶,则配制的稀盐酸浓度是(填“偏高”、“偏低”或“无影响”)。
在标准状况下,将224 L HCl气体溶于635 mL水中,所得盐酸的密度为1.18 g·cm-3。试计算:
(1)所得盐酸的质量分数和物质的量浓度分别是、。
(2)取出这种盐酸100 mL,稀释至1.18 L,所得稀盐酸的物质的量浓度是。
(3)在40.0 mL 0.065 mol·L-1 Na2CO3溶液中,逐渐加入(2)所稀释的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不超过mL。
(4)将不纯的NaOH样品1 g(样品含少量Na2CO3和水),放入50 mL 2 mol·L-1的盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40 mL 1 mol·L-1的NaOH溶液。蒸发中和后的溶液,最终得到克固体。