有①NH2-CH2-COOH ②CH2OH(CHOH)4CHO ③(C6H10O5)n(纤维素)④HCOOC2H5 ⑤苯酚 ⑥HCHO等物质,其中(用数字序号填空):
(1)易溶于水的是 ,常温下微溶于水的 。
(2)能发生银镜反应的是 ________________ 。
(3)能发生酯化反应的是 _______________。
(4)能在一定条件下能水解的是 。
(5)能跟氢氧化钠溶液反应的是 。
β羧乙基锗倍半氧化物(即Ge-132)是与人体健康有关的最重要的有机锗化合物,其片层结构如图1-24所示,其重复结构是由六个锗原子和六个氧原子构成的十二元环。每个锗原子还同时与三个氧原子相连,形成可以任意延伸的片层,每个锗原子连接一个羧乙基(—CH2CH2COOH),各片层间存在相互作用,连接成三维网状结构。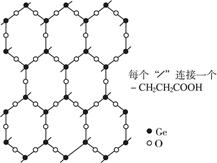
图1-24
(1)每个正六边形拥有 个锗原子, 个氧原子。
(2)试写出Ge132的化学式。
X、Y、Z、W都是短周期元素,原子半径为W>Z>X>Y。已知:X、Y两元素处于同一周期,X、Z处于周一主族,Z原子核内的质子数等于X、Y原子核内的质子数之和;Z原子最外电子层上的电子数是W原子最外电子层上的电子数的4倍。试回答:
(1)这四种元素单质(若有同素异形体只考虑熔点最高的)的熔点由高到低的顺序是(写化学式)。
(2)由这四种元素组成的两种正盐的水溶液(均为0.1 mol·L-1)的pH由大到小的顺序是(写化学式)。
(3)Y和Z两元素可形成化合物ZY2,某种ZY2晶体的结构相当于把金刚石中原子均换成Z原子,再在原两个Z原子连线的中点位置放一个Y原子,则此晶体中由Z、Y原子组成的最小环是元环,在此最小环上有个Y原子和个Z原子。
m、n、x、y四种主族元素在周期表里的相对位置如下所示,已知它们的原子序数总和为46。
| m |
n |
||
| x |
y |
(1)m与y形成的化合物中含键,属分子(填“极性”或“非极性”)。
(2)由n、y的氢化物相互作用所生成的物质的电子式为。
(3)写出m单质与x元素最高价氧化物对应的水化物反应的化学方程式为
。
(4)核电荷数比x元素少8的元素可形成多种粒子,按要求填入空格中:
| 质子数 |
16 |
16 |
16 |
| 电子数 |
16 |
17 |
18 |
| 化学式 |
β羧乙基锗倍半氧化物(即Ge-132)是与人体健康有关的最重要的有机锗化合物,其片层结构如图1-24所示,其重复结构是由六个锗原子和六个氧原子构成的十二元环。每个锗原子还同时与三个氧原子相连,形成可以任意延伸的片层,每个锗原子连接一个羧乙基(—CH2CH2COOH),各片层间存在相互作用,连接成三维网状结构。
图1-24
(1)每个正六边形拥有 个锗原子, 个氧原子。
(2)试写出Ge132的化学式。
在KI 淀粉溶液中,滴加少量Na2ClO溶液,并加入少量稀H2SO4,溶液立即变蓝,这是因为____________,离子方程式是________________。
在上述蓝色的溶液中滴加足量的Na2SO3溶液,蓝色逐渐消失,这是因为_________,离子方程式是________________________________________。
从以上实验可知, ClO-、I2、 的氧化性由强到弱的顺序是_________________________。
的氧化性由强到弱的顺序是_________________________。