下列描述正确的是 ( )
A.实验室中制取乙酸乙酯的方程式为: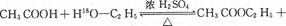  |
| B.向明矾溶液中滴入少量氢氧化钡溶液:2Al3++3SO42-+3Ba2++6OH- =3BaSO4+2Al(OH)3 |
| C.加入Al能放出H2的溶液中:NH4+、SO42—、Cl一、HCO3—能大量共存 |
| D.加入二氧化锰固体可冒出气泡的溶液中:K+、Mg2+、l一、N03一大量能共存 |
对于可逆反应mA(g)+nB(s) pC(g)+qD( g),反应过程中,其他条件不变时,产物D的物质的量分数D%与温度T或压强p的关系如图,下列说法正确的是
pC(g)+qD( g),反应过程中,其他条件不变时,产物D的物质的量分数D%与温度T或压强p的关系如图,下列说法正确的是
| A.化学方程式中化学计量数:p+q> m+n |
| B.降温可使化学平衡向正反应方向移动 |
| C.使用合适的催化剂可使D%有所增加 |
| D.加入少量的B,正反应速率加快,有利于平衡向正反应方向移动 |
体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2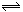 2SO3,并达到平衡。在这过程中,甲容器保持压强不变,乙容器保持体积不变,若甲容器中SO2的转化率为P%,则乙容器中SO2的转化率
2SO3,并达到平衡。在这过程中,甲容器保持压强不变,乙容器保持体积不变,若甲容器中SO2的转化率为P%,则乙容器中SO2的转化率
| A.等于P% | B.小于P% | C.大于P% | D.无法判断 |
FeCl3(aq)与KSCN(aq)混合时存在下列平衡:Fe3+(aq)+SCN-(aq) Fe(SCN)2+(aq)。已知平衡时,物质的量浓度c[Fe(SCN)2+]与温度T的关系如图所示,则下列说法正确的是
Fe(SCN)2+(aq)。已知平衡时,物质的量浓度c[Fe(SCN)2+]与温度T的关系如图所示,则下列说法正确的是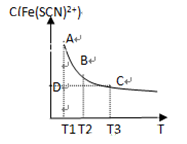
| A.FeCl3(aq)与KSCN(aq)反应的热化学反应方程式为 Fe3+(aq)+SCN—(aq)  Fe(SCN)2+(aq) ΔH >0 Fe(SCN)2+(aq) ΔH >0 |
| B.温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1<K2 |
| C.反应处于D点时,一定有υ正>υ逆 |
| D.A点与B点相比,A点的c(Fe3+)大 |
一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如下图所示。下列判断正确的是
| A.在0~50 min之间,pH=2和pH=7时R的降解百分率相等 |
| B.溶液酸性越强,R的降解速率越小 |
| C.R的起始浓度越小,降解速率越大 |
| D.在20~25 min之间,pH=10时R的平均降解速率为0.04 mol·L-1·min-1 |
根据下列有关图象,说法正确的是
| A.由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的ΔH<0 |
| B.由图Ⅱ知,反应在t6时刻,NH3体积分数最大 |
| C.由图Ⅱ知,t3时采取增大反应体系压强的措施 |
| D.图Ⅲ表示在10 L容器、850℃时的反应,由图知,到4 min时,反应放出51.6 kJ的热量 |