对可逆反应4NH3(g)+5O2(g)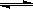 4NO(g) + 6H2O(g),下列叙述正确的是
4NO(g) + 6H2O(g),下列叙述正确的是
| A.平衡时,v正(O2)=v逆(O2)必成立 |
| B.关系式5v正(O2)=4v正(NO)总成立 |
| C.用上述四种物质NH3、O2、NO、H2O表示的正反应速率的数值中,v正(H2O)最小 |
| D.若投入4 mol NH3和5 mol O2,通过控制外界条件,必能生成4 mol NO |
下列各组物质中,所有化学键都是共价键的是()。
| A.H2S和Na2O2 | B.H2O2和CaF2 |
| C.NH3和N2 | D.HNO3和NaCl |
下列对共价键的说法中,不正确的是()。
| A.共价键是通过形成共用电子对或原子轨道重叠形成的 |
| B.形成共价键的原子之间电负性相同或相差不大 |
| C.一般情况下一个原子有几个不成对电子就会和几个自旋相反的未成对电子成键 |
| D.共价键是通过共用电子对形成的,不属于电性作用 |
R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数)()。
| A.若R(OH)n为强碱,则W(OH)(n+1)也为强碱 |
| B.若HnXOm为强酸,则Y是活泼非金属元素 |
| C.若Y的最低化合价为-2,则Z的最高正化合价为+6 |
| D.若X的最高正化合价为+5,则五种元素都是非金属元素 |
下列各组表述中,两个微粒不属于同种元素原子的是()。
| A.3p能级有一个空轨道的基态原子和核外电子的排布为1s22s22p63s23p2的原子 |
| B.2p能级无空轨道,且有一个未成对电子的基态原子和原子的最外层电子排布为2s22p5的原子 |
| C.M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p64s2的原子 |
D.最外层电子数是核外电子总数的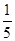 的原子和最外层电子排布为4s24p5的原子 的原子和最外层电子排布为4s24p5的原子 |
下列排列顺序中错误的是()。
| A.原子半径:O<S<Na |
| B.稳定性:PH3>H2S>NH3 |
| C.酸性:H3PO4<H2SO4<HClO4 |
| D.碱性:Al(OH)3<Mg(OH)2<NaOH |