下列说法不正确的是
| A.二氧化硫是形成酸雨的一种有毒的酸性氧化物 | B.浓盐酸可以用铝制容器盛装 |
| C.浓硝酸保存需要用棕色瓶 | D.NaClO中既有离子键又有共价键 |
还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:
已知转化过程中的反应为 。
。
转化后所得溶液中铬元素的含量为28.6 g/L,CrO42-有10/11转化为Cr2O72-,下列说法不正确的是
| A.溶液颜色保持不变,说明上述可逆反应达到平衡状态 |
B.若用绿矾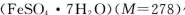 作还原剂,处理1L废水,至少需要917.4 g 作还原剂,处理1L废水,至少需要917.4 g |
| C.常温下转化反应的平衡常数K=l×10.则转化后所得溶液的pH=6 |
D.常温下 ,要使处理后废水中的c(Cr3+)降至1×10 ,要使处理后废水中的c(Cr3+)降至1×10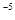 mol/L,应调溶液的pH=5 mol/L,应调溶液的pH=5 |
某溶液中可能含有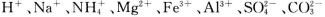 等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图像如图所示,下列说法正确的是
等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化的图像如图所示,下列说法正确的是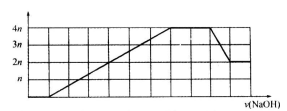
A.原溶液中一定含有的阳离子是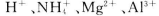 |
| B.原溶液中一定含有SO42-和Na+ |
| C.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
| D.反应最后形成的溶液中含有的溶质仅为Na2SO4 |
下列图示与对应的叙述相符的是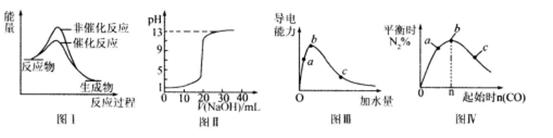
| A.图I表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B.图Ⅱ表示常温下,0. 100 mol/L NaOH溶液滴定20. 00 mL、0.100 mol/L HC1溶液所得到的滴定曲线。 |
| C.图Ⅲ表示一定质量的冰醋酸加水稀释过程中,醋酸溶液电离程度:c<a<b |
D.图Ⅳ表示反应 ,在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知的转化率c>b>a ,在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知的转化率c>b>a |
下列说法或解释不正确的是
A.等物质的量浓度的下列溶液中,  由大到小的顺序是①>②>③>④ 由大到小的顺序是①>②>③>④ |
B.室温下,向0. 01 mol NH4HSO4溶液中滴加NaOH溶液至中性: NH4HSO4溶液中滴加NaOH溶液至中性: |
C.向0.2 mol NaHCO3溶液中加入等体积0.1 mol NaHCO3溶液中加入等体积0.1 mol NaOH溶液: NaOH溶液: |
D.物质的量浓度均为1 mol 的NaCl和MgCl2混合液1L中,含有Cl-的数目为3 的NaCl和MgCl2混合液1L中,含有Cl-的数目为3 ( ( 表示阿伏加德罗常数的值) 表示阿伏加德罗常数的值) |
某学生鉴定甲盐的流程如图所示,下列说法正确的是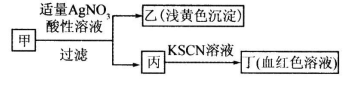
| A.如果甲中含有S2-,则乙是硫磺沉淀 |
| B.如果乙是AgCl沉淀,那么甲是FeCl3 |
| C.丙中肯定含有Fe3+,所以甲是FeBr2 |
| D.甲中含有铁元素,可能显示+2或者+3价 |