⑴① NH3 ②SO3 ③Cl2 ④BaSO4 ⑤酒精 ⑥CH3COONH4 ⑦HClO ⑧Cu。
以上物质中属于非电解质的是 ,属于强电解质的是 。
⑵常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是 (填“A”或“B”),设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2。则m1 m2(填“<”、“=”、“>”)。
⑶在25℃时,有pH为a(a≤6)的盐酸和pH为b(b≥8)的NaOH溶液,取Va L该盐酸,与该NaOH溶液中和,需Vb LNaOH溶液。若a + b>15,则Va∶Vb = (填表达式),且Va Vb(填“>”“<”或“=”)
家用液化气的主要成分之一是丁烷,试写出表示丁烷燃烧热的热化学方程式:
(查阅资料:丁烷的燃烧热为---2900kJ/mol。)
(1)
(2)已知:C(s)+O2(g)=CO2(g);ΔH=-393.5 kJ/mol;
2H2(g)+O2(g)=2H2O(g);ΔH=-483.6 kJ/mol,现有0.2 mol的炭粉和氢气组成的悬浮气,且混合物在氧气中完全燃烧,共放出63.53 kJ热量,则混合物中C与H2的物质的量之比为
书写下列物质的电离方程式:
Ba(OH)2Al2(SO4)3 H2CO3
(9分)认真观察下列装置,回答下列问题: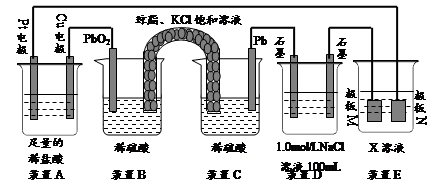
⑴装置B中PbO2上发生的电极反应方程式为。
⑵装置A中总反应的离子方程式为。
⑶若装置E中的目的是在Cu材料上镀银,则X为,极板N的材料为。
若装置E的目的是验证金属的电化学防腐,则极板N的材料为__________________ 。
⑷当装置A中Cu电极质量改变6.4g时,装置D中产生的气体体积为L(标准状况下)。
(12分)⑴已知甲醇在常温下为液体,其热值为22.7kJ•g-1,则甲醇的标准燃烧热的热化学方程式为_______________________________________________。
⑵将甲醇、氧气和氢氧化钾溶液设计成燃料电池,该电池正极反应式为
____________________________________。
⑶右图为工业上氯碱工业的电解槽示意图,据图回答: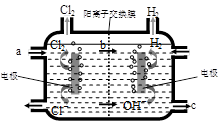
①图中a、b、c处物质名称分别是: a_________________;b________________;c___________________。
②若没有阳离子交换膜,则电解一段时间后在电解槽的溶液中可能发生的化学反应方程式为__________________________。
⑷反应2A B+C 在某一温度时达到平衡。
B+C 在某一温度时达到平衡。
①若温度升高,平衡向正反应方向移动,则正反应是__________热反应;
②若B为固体,降低压强平衡向逆反应方向移动,则A呈____________态;
③若A是气态时,加压时,平衡不移动,则B为_________态,C为________态。
(12)下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||
| 4 |
⑨ |
(1) 在这些元素中,化学性质最不活泼的是:(填元素符号)。
(2) 在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______,④和⑨的最高价氧化物的水化物碱性强弱的比较:_____________(填相应化学式)。
(3) 最高价氧化是两性氧化物的元素是_____ ____(填元素符号);写出它的氧化物与氢氧化钠反应的离子方程式_____ _________ _________ _________ _________ ____。
(4)表示①和⑦生成的化合物的电子式,