氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
⑴氢氧燃料电池的能量转化主要形式是 ,
在导线中电子流动方向为 (用a、b 表示)。
⑵负极反应式为 。
⑶电极表面镀铂粉的原因为 。
⑷该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下: Ⅰ. 2Li + H2
Ⅰ. 2Li + H2  2LiH Ⅱ. LiH + H2O ="=" LiOH + H2↑
2LiH Ⅱ. LiH + H2O ="=" LiOH + H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
②已知LiH固体密度约为0.8g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
试回答下列问题
(1)元素“O”在周期表中的位置是。
(2)画出“c”的简化电子排布式。
(3)第三周期8种元素按单质熔点大小顺序的柱形图如上,其中序列“1”代表(填字母)。
(4)b、c、d、e、f的氢化物的沸点(℃)直角坐标图如右,序列“5”氢化物的化学式为:;序列“1”氢化物的电子式为:。
氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+
与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
⑴写出N2H62+在碱性溶液中反应的离子方程式。
⑵NH2-的电子式为。
⑶N3-有个电子。
⑷写出二种由多个原子组成的含有与N3-电子数相同的物质的化学式、。
⑸等电子数的微粒往往具有相似的结构,试预测N3—的构型。
⑹据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N≡N键。则“N5”分子碎片所带电荷是。
运送“神舟五号”飞船的火箭燃料除液态双氧水外,还有另一种液态氮氢化合物。已知该化合物中氢元素的质量分数为12. 5%,相对分子质量为32,结构分析发现该分子结构中只有单键。
(1)该氮氢化合物的电子为。
(2)若该物质与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,写出该反应的化学方程式。
(3)NH3分子中的N原子有一对孤对电子,能发生反应:NH3+HCl=NH4Cl。试写出上述氮氢化合物通入足量盐酸时,发生反应的化学方程式
M原子在第二能层上只有一个空轨道,则M是;其电子排布式为;R原子的3p轨道上只有一个未成对电子,则R原子可能是、;Y原子的核电荷数为33,其外围电子排布是,其在元素周期表中的位置是,是属于区的元素。
A、B、C、D、E都是元素周期表中的前20号元素,它们的原子序数依次递增。已知B、D两种元素原子的最外层电子数是最内层电子数的两倍,而C元素原子的最外层电子数等于B元素原子的核外电子数,E的价电子数为1.回答下列问题。
(1)画出C元素的原子结构示意图。
(2)在1mol DC2中,有mol D—C键。
(3)在化合物BC2的晶体中,每个BC2分子周围与它距离最近的BC2分子有个。
(4)原子序数介于B、C之间的元素X和B、C都可与A形成10e-的化合物。则X、B、C的第一电离能顺序是 (填元素符号),三种10e-的化合物中沸点最低的。
(5)已知高温下C和E元素形成的晶体呈立方体结构,晶体中元素C的化合价部分为0价,部分为-2价。如下图所示为C和E元素形成的晶体的一个晶胞(晶体中最小的重复单元),则下列说法中正确的是 。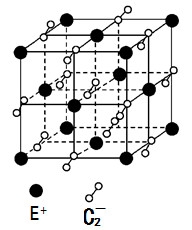
A.该晶体化学式为EC2(KO2),每个晶胞含有个4个E+和4个C2-
B.晶体中每个E+周围有8个C2-,每个C2-周围有8个E+
C.晶体中与每个E+距离最近的E+有8个
D.晶体中,0价C与-2价C的数目比为3:1
E.C2-与N2互为等电子体