有一铁的氧化物样品,用5 mol/L的盐酸140mL恰好完全溶解,所得溶液还能吸收标况下0.56L Cl2,使亚铁离子全部变成Fe3+,则该氧化物可能的化学式为
| A.Fe2O3 | B.Fe3O4 | C.Fe4O3 | D.Fe5O7 |
可逆反应aA(s)+bB(g) cC(g)+dD(g);ΔH=Q,在反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如下图所示:
cC(g)+dD(g);ΔH=Q,在反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如下图所示: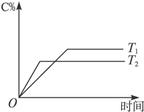
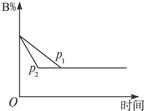
根据上图分析,以下正确的是()
| A.T1>T2,Q>0 | B.T2>T1,Q<0 |
| C.p1>p2,a+b="c+d" | D.p1<p2,b<c+d |
0.3 mol的气态高能燃料乙硼烷B2H6在O2中燃烧,生成固态B2O3和液态H2O,放出649.5 kJ的热量。下列热化学方程式中正确的是()
| A.B2H6(g)+3O2(g)====B2O3(s)+3H2O(l);ΔH="+2" 165 kJ·mol-1 |
| B.B2H6(g)+3O2(g)====B2O3(s)+3H2O(l);ΔH="-2" 165 kJ·mol-1 |
| C.B2H6+3O2====B2O3+3H2O;ΔH="-2" 165 kJ·mol-1 |
| D.B2H6(g)+O2(g)====B2O3(s)+H2O(g);ΔH="-2" 165 kJ·mol-1 |
下列叙述中正确的是()
| A.热化学方程式2H2(g)+O2(g)====H2O(l);ΔH="-571.6" kJ·mol-1中ΔH表示H2的燃烧热 |
| B.分子晶体的熔点、沸点随共价键增强而升高 |
| C.非金属元素呈现的最高化合价不超过该元素原子的最外层电子数 |
| D.阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同 |
燃烧1 g乙炔生成二氧化碳和液态水,放出热量50 kJ,则这一反应的热化学反应方程式为()
| A.2C2H2(g)+5O2(g)====4CO2(g)+2H2O(l);ΔH="+50" kJ·mol-1 |
| B.C2H2(g)+5/2O2(g)====2CO2(g)+H2O;ΔH="-1" 300 kJ |
| C.2C2H2+5O2====4CO2+2H2O;ΔH="-2" 600 kJ |
| D.2C2H2(g)+5O2(g)====4CO2(g)+2H2O(l);ΔH="-2" 600 kJ·mol-1 |
对于反应C2H4(g)→C2H2(g)十H2(g),2CH4(g)→C2H4(g)+2H2(g)当升高温度时都向右移动①C(s)+2H2(g)→CH4(g);△H1 ②2C(s)+ H2(g)→C2H2(g);△H2 ③2C(s)+2H2(g)→C2H4 (g);△H3。判定①②③中的△H1,△H2,△H3大小顺序是()
| A.△H1>△H2>△H3 | B.△H2>△H3>2△H1 |
| C.△H2>△H1>△H3 | D.△H3>△H2>2△Hl |