下列关于原电池的叙述中,正确的是
| A.原电池中,正极就是阳极,负极就是阴极 | B.形成原电池时,在负极上发生氧化反应 |
| C.原电池工作时,溶液中的阳离子向负极移动 | D.电子从负极流向正极 |
反应FeO(s)+C(s)=Fe(s)+CO(g); △H>0,ΔS>0,下列说法正确的是()
A.低温下自发进行,高温下非自发进行 B 高温下自发进行,低温下非自发进行
C.任何温度下均为非自发进行 D任何温度下均为自发进行
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的 ①NaOH固体②H2O③NH4Cl固体④CH3COONa固体⑤NaNO3固体⑥KCl溶液()
| A.②④⑥ | B.①② | C.②③⑤ | D.②④⑤⑥ |
设C+CO2  2CO(正反应为吸热反应),反应速率为v1;N2+3H2
2CO(正反应为吸热反应),反应速率为v1;N2+3H2  2NH3(正反应为放热反应),反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为
2NH3(正反应为放热反应),反应速率为v2,对于上述反应,当温度升高时,v1和v2的变化情况为
| A.同时增大 | B.同时减小 |
| C.v1增大,v2减小 | D.v1减小,v2增大 |
用石墨作电极,电解下列溶液,阴、阳两极均产生气体,其体积比为2:1,且电解后溶液
的pH增大的是()
| A.KCl | B.NaOH | C.Na2SO4 | D.H2SO4 |
如图所示,A池用石墨电极电解氢氧化钠溶液,B池精炼粗铜。一段时间后停止通电,A池D极产生的气体在标准状况下为2.24L,则B池中E极质量的变化是 ()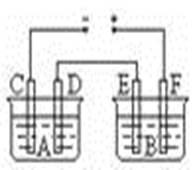
| A.质量增加6.4g | B.质量增加12.8g |
| C.质量减少6.4g | D.质量减少12.8g |