氮化钠和氢化钠都是离子化合物,与水反应的化学方程式(未配平)如下:
Na3N+H2O→NaOH+NH3,NaH+H2O→NaOH+H2。有关它们的叙述
① 离子半径:Na+>N3->H+; ② 与水反应都是氧化还原反应; ③ 与水反应后的溶液都显碱性 ④ 与盐酸反应都只生成一种盐; ⑤ 两种化合物中的阴阳离子均具有相同的电子层结构。其中正确的是
| A.②③④⑤ | B.①③⑤ | C.②④ | D.③ |
下列有关化学用语正确的是
| A.26Fe的价层电子排布式为3d64s2 |
| B.35Br的电子排布式可简写为[Ar]4s24p5 |
C.NH4Cl的电子式为 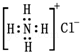 |
D.氯离子结构示意图为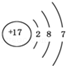 |
碱性硼化钒(VB2)—空气电池工作时反应为:4VB2 + 11O2 = 4B2O3 + 2V2O5。用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是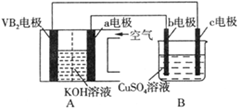
| A.VB2电极发生的电极反应为:2VB2 + 11H2O - 22e- = V2O5 + 2B2O3 + 22H+ |
| B.外电路中电子由c电极流向VB2电极 |
| C.电解过程中,b电极表面先有红色物质析出,然后有气泡产生 |
| D.若B装置内的液体体积为200 mL,则CuSO4溶液的物质的量浓度为0.05 mol/L |
下列有关化学反应原理的说法不正确的是
| A.强酸和强碱的中和反应的活化能接近于零,所以反应速率很高 |
| B.过程的自发性既能用于判断过程的方向,也能用于判断过程发生的速率 |
| C.电解质溶液导电的过程中,一定发生了电解质溶液的电解 |
| D.溶解度较小的BaSO4在一定条件下也可以转化为溶解度略大的BaCO3 |
一定温度下,向300 mL l mol/L的NaOH溶液中通入bmol CO2,下列说法正确的是
| A.通入CO2过程中溶液中的Kw减小 |
| B.b=0.3与b=0.15时,所得溶液中的微粒种类不相同 |
| C.当b=0.2时,所得溶液中部分离子浓度关系为:c(HCO3一)>c(CO32-)>c(OH-)>c(H+) |
| D.当恰好生成NaHCO3时,溶液中存在:c(Na+ )+c(H十)=c(HCO3-)+c(OH一) |
25℃时,用浓度为0.1000 mol/L的NaOH溶液滴定20.00 mL浓度均为0.1000 mol/L的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法不正确的是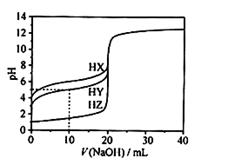
| A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ>HY>HX |
| B.根据滴定曲线,可得Ka(HY)≈10—5 |
| C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(Y—)>c(X—)>c(OH—)>c(H+) |
D.HY与HZ混合,达到平衡时: |