下列物质性质的变化规律,与共价键的键能大小有关的是
①F2、Cl2、Br2、I2的熔点、沸点逐渐升高 ②HF、HCl、HBr、HI的热稳定性依次减弱
③金刚石的硬度、熔点、沸点都高于晶体硅 ④NaF、NaCl、NaBr、NaI的熔点依次降低
| A.仅② | B.仅③ | C.②③ | D.①②③ |
化学与生活、社会密切相关,下列说法正确的是
| A.SO2和NO2都是有用的化工原料,因此目前都是将汽车尾气中的氮氧化合物收集后制备硝酸以防止污染空气 |
| B.由于HClO具有漂白性,因此工业上常用Cl2的水溶液来漂白纸浆、毛、丝、草帽辫 |
| C.高锰酸钾溶液、酒精、双氧水都能杀菌消毒,消毒原理相同,都利用了强氧化性 |
| D.金属钠通常被保存在煤油中,以隔绝空气 |
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)=I3-(aq) , 某 I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是: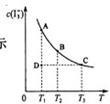
| A.反应I2(aq)+I-(aq)=I3-(aq)的△H>0 |
| B.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1<K2 |
| C.若反应进行到状态D时,一定有v正>v逆 |
| D.状态A与状态B相比,状态A的c(I2)大 |
下列溶液中微粒的物质的量浓度关系正确的是:
| A.室温下,向0.01mol·L-1NH4HSO4溶液中滴加NaOH 溶液至中性: c(Na+)>c((SO42-)>c(NH4+)>c(OH-)=c(H+) |
| B.0.1mol·L-1NaHCO3溶液: c(Na+)>c(OH-)>c((HCO3-)>c(H+) |
| C.Na2CO3溶液:c(OH-)-c(H+)=c(HCO3-)+ 2c(H2CO3) |
| D.25℃时,,pH=4.75、浓度均为0.1mol·L-1的CH3COOH 、CH3COONa 混合溶液:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
下列有关离子检验的操作和实验结论都正确的是(
| 选项 |
实验操作及现象 |
实验结论 |
| A |
向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶解 |
该溶液中一定含有SO42- |
| B |
向某溶液中加入足量的盐酸无明显现象,再加入BaCl2溶液,产生白色沉淀 |
原溶液中一定含有SO42- |
| C |
向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色无味气体 |
该溶液中一定含有CO32- |
| D |
用铂丝蘸取某溶液在无色火焰上灼烧直接观察火焰颜色未见紫色 |
原溶液中不含K+ |
阿司匹林是日常生活中应用广泛的医药之一。它可由下列方法合成:
下列说法正确的是
| A.邻羟基苯甲醛分子中所有的原子可能在同一平面 |
| B.用酸性KMnO4溶液直接氧化邻羟基苯甲醛可实现反应① |
| C.反应②中加入适量的NaHCO3可提高阿司匹林的产率 |
| D.与邻羟基苯甲酸互为同分异构体,苯环上一氯代物仅有2种且能发生银镜反应的酚类化合物共有3种 |