A、B、C、D、E、F、G均是原子序数小于36的元素。A的基态原子外围电子排布式为3s2;B原子的L电子层的P能级上有一个空轨道; C元素的基态原子最外层有3个未成对电子,次外层有2个电子; D 的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;E是海水中除氢、氧元素外含量最多的元素;F和G在周期表中既处于同一周期又位于同一族,且原子序数F比G小2。
根据信息回答下列问题:
(1)C的外围电子排布图为 。C与氢元素可分别形成含10个电子的分子、阴离子和阳离子,阳离子中中心原子的杂化类型为 ;分子的VSEPR模型名称为 ;阴离子的立体构型为___ __。
(2)G的价电子排布式为 。用电子式表示化合物AE2的形成过程 。
(3)F与BD易形成配合物F(BD)5,在F(BD)5中F的化合价为_______;与BD分子互为等电子体的分子和离子分别为 和 (填化学式)。
(4)E有多种含氧酸根①EO- ②EO2- ③EO3- ④EO4-,其中空间构型为四面体型的是 。(填序号)
(5)B、C、D、E原子相互化合形成的分子有多种,请列举两种分子内所有原子都满足最外层8电子稳定结构的分子:______________________(写分子式)
(10分)已知A、B、C、D、E五种元素的原子序数依次增大,其中A原子所处的周期数、族序数都与其原子序数相等;B原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;D原子L电子层上有2对成对电子;E的+1价阳离子的核外有3层电子且各层均处于全满状态。
(1)E元素基态原子的核外电子排布式为___________________。
(2)B、C、D三种元素的第一电离能由小到大的顺序为_______(填元素符号)。其原因是。
(3)B2A4是石油炼制的重要产物之一 。B2A4分子中B原子轨道的杂化类型为________;1 mol B2A2分子中含________mol σ键。
(4)已知D、E能形成晶胞结构如图所示的两种化合物,则化学式:甲为______,乙为______;高温时,甲易转化为乙的原因为______________________________。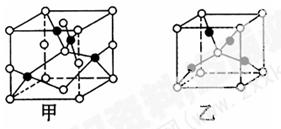
(8分)氮及其化合物在生产、生活和科技等方面有着重要的应用。请回答下列问题。
(1)氮原子的原子结构示意图为________________________________。
(2)氮气的电子式为________,在氮气分子中,氮原子之间存在着________个σ键和________个π键。
(3)磷、氮、氧是周期表中相邻的三种元素,比较:(均填“大于”“小于”或“等于”)
①氮原子的第一电离能________磷原子的第一电离能;
②N2分子中N—N键的键长________白磷分子中P—P键的键长。
(4)氮元素的氢化物(NH3)是一种易液化的气体,请阐述原因是__________________。
(8分)元素A、B、C都是短周期元素,A元素原子的2p轨道上只有两个未成对电子,B的3p轨道上有空轨道,A、B同主族,B、C同周期,C是本周期中电负性最大的。请回答:
(1)A原子的核外电子排布的轨道表示式________,B原子的核外电子排布式__________________,C原子的价电子排布式________。
(2)A、B、C的气态氢化物中最不稳定的是________(填化学式)。
(3) A、B、C的最高价氧化物的水化物中,酸性最强的是________。
(4)AC4的结构式为________,中心原子A的杂化方式________杂化,是________(填“极性”或“非极性”)分子。
(每空1分,共10分)根据已学知识,请你回答下列问题:
(1)含有8个质子,10个中子的原子的化学符号__________。
(2)最外层电子排布为4s24p1的原子的核电荷数为__________。
(3)某元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布是4s24p4,该元素的名称是_________。
(4)根据VSEPR模型,H3O+的分子立体结构为:,SO2的立体结构为:。
(5)周期表中最活泼的非金属元素原子的轨道表示式为__________。
( 6 ) 三氯化铁常温下为固体,熔点282°C,沸点315°,在300°C以上易升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为________。
( 7 ) 某元素核外有三个电子层,最外层电子数是核外电子总数的1/6,写出该元素原子的电子排布式是__________。
( 8 )写出铬元素在周期表中的位置__________,它位于__________区。
(14分)酯类物质A(C11H8O4)在氢氧化钠溶液中加热反应后再酸化可得到化合物B和C。
回答下列问题:
①B的分子式为C2H4O2,分子中只有一个官能团。则B的结构简式是________,B与乙醇在浓硫酸催化下加热反应生成D,该反应的化学方程式是________________________,该反应的类型是________;写出两种具有醛基(—CHO)的B的同分异构体的结构简式________________________________。
②C是芳香族化合物,相对分子质量为180。其碳的质量分数为60.0%,氢的质量分数为4.44%,其余为氧,则C的分子式是________。
③已知C的苯环上有三个取代基。其中一个取代基无支链,且含有能使溴的四氯化碳溶液褪色的官能团及能与碳酸氢钠溶液反应放出气体的官能团,则该取代基上的官能团名称是________,另外两个取代基相同,分别位于该取代基的邻位和对位,则C的结构简式是________________。如果只变化物质C苯环上三个取代基的位置,则可以得到________种C的同分异构体。