配平并完成下面离子方程式:
HCl + KClO3= Cl2 + KCl+ [ ]
有A、B、C、D四种物质,B的焰色反应为黄色。C是酸式盐,C加入硝酸酸化的Ba(NO3)2溶液中有白色沉淀生成。D和G相遇有大量白烟生成,D通入硝酸酸化的AgNO3溶液有白色沉淀生成。对A、B、C、D四种物质的水溶液进行下列实验,过程和现象如下图所示(图中部分产物未列出),请回答下列问题: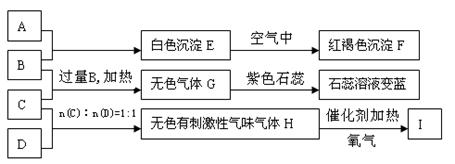
(1)B的电子式为____________________。
(2)H生成I的化学方程式为 。
(3)G在同主族同类物质中稳定性最强____,也是沸点最高的。(判断正误填“是”或“否”)
(4)A溶液中加入D,A溶液的颜色由浅绿色变黄,则A的化学式为__________ 。
(5)写出C与过量B反应(加热)的离子方程式 。
(6)C与D溶液恰好反应,假设生成气体全部逸出,所得溶液中离子浓度从大到小的顺序。
(7)25℃时pH=9的B溶液和pH=9的G溶液中,水的电离程度B___________G(填>,<或=)。
Suzuki偶联反应在有机合成上有广泛应用,该方法可以应用于合成昆虫信息素。其反应①如下(Ph-代表苯基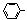 ):
):
反应①:
化合物I可以由以下途径合成: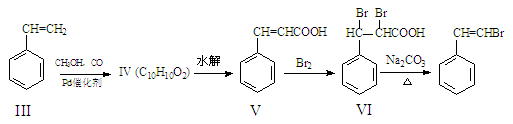
(1)化合物I的分子式为,1mol 化合物III完全燃烧消耗氧气mol。
(2)化合物IV的结构简式为,化合物V转化为化合物VI的反应类型为。
(3)写出化合物VI在足量的NaOH溶液中共热反应的方程式。
(4)已知化合物Ⅶ是化合物V的同分异构体,化合物Ⅶ的核磁共振氢谱中有 4种峰,峰面积之比为3:2:2:1,且1mol Ⅶ与足量银氨溶液反应生成4mol Ag单质,写出化合物Ⅶ的结构简式。
(5)化合物( )与化合物(
)与化合物( )能发生偶联反应生成一种抗抑郁药物,写出该抗抑郁药物的结构简式。
)能发生偶联反应生成一种抗抑郁药物,写出该抗抑郁药物的结构简式。
二氧化钛(TiO2)又称钛白,工业上利用钛铁矿(主要成分FeTiO3,其中铁为正二价)为原料,采用硫酸法制得,其工艺流程如下图所示
请回答:
(1)铁矿加入硫酸反应可制得硫酸氧钛,其反应的化学方程式为:
FeTiO3+ 2H2SO4=( )TiOSO4+( )+( );
(2)为了提高二氧化钛的纯度,需要除去浸出液中的Fe3+,则加入的试剂A为,需过量的原因是。
(3)操作1是。
(4)进行操作1时需将滤液1在70-75℃,压力8000Pa的条件下真空蒸发器中进行,其原因是为了防止,滤液2加水稀释使硫酸氧钛(TiOSO4)水解生成偏钛酸(TiO2·nH2O),请写出该水解反应的化学方程式。
已知2SO2(g)十O2(g) 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。
请回答下列问题:
(1)1mol SO2(g)氧化为1mol SO3(g)放出的热量为99.00kJ·mol-1,写出该反应的热化学方程式。
(2)①在图中标出该反应的活化能E和反应热△H;
②该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低,请在图中画图表示出来,并进行必要的标注。
(3)能够说明在恒温恒容条件下,上述反应已经达到化学平衡状态的是。
| A.容器中气体总压强不变 | B.容器中混合气体的密度不变 |
| C.每生成1mol SO3的同时生成1molSO2 | D.SO2、O2、SO3的物质的量之比为2∶1∶2 |
(4)在400℃,常压下,向体积为2L的密闭容器中充入2mol SO2(g)和1.92mol O2(g),充分反应后,测得还有0.08mol SO2剩余,求该反应的平衡常数(要求写出计算过程)。
已知化合物Ⅰ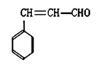 和化合物Ⅱ
和化合物Ⅱ 在一定条件下发生反应能生成化合物III
在一定条件下发生反应能生成化合物III ,请回答以下问题。
,请回答以下问题。
(1)物质Ⅰ的化学式为;
(2)下列对物质Ⅱ的说法正确的是;
| A.能发生加成反应 | B.具有5种不同化学环境的氢原子 |
| C.能与NaHCO3溶液反应生成CO2 | D.能与新制Cu(OH)2反应生成红色沉淀Cu2O |
(3)写出化合物II符合下列条件的任意两种同分异构体,;
①苯环上只有一个取代基②含有酯基
(4)写出物质III发生加聚反应的化学方程式;
(5)物质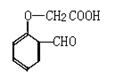 在一定条件下能发生类似化合物I和化合物II生成化合物III的反应,请写出类似化合物III的生成物的结构简式 。
在一定条件下能发生类似化合物I和化合物II生成化合物III的反应,请写出类似化合物III的生成物的结构简式 。