室温时,下列混合溶液的pH一定小于7的是
| A.pH=4的盐酸和pH=10的氨水等体积混合 |
| B.pH=2的盐酸和pH=13的氢氧化钡等体积混合 |
| C.pH=5的醋酸和pH=9的氢氧化钡等体积混合 |
| D.pH=3的硫酸和pH=11的氨水等体积混合 |
氯气在298K、101kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应。估算该反应的平衡常数()
| A.5.4×10—5 | B.4.5×10—4 | C.0.015 | D.无法计算 |
关于下列各装置图的叙述不正确的是()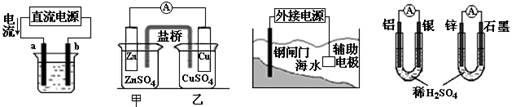
①②③④
| A.用图①装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液 |
| B.图②装置的盐桥中KCl的Cl—移向甲烧杯 |
| C.图③装置中钢闸门应与外接电源的正极相连获得保护 |
| D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同 |
化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
A.氢化铵的电子式: |
B.甲醇分子的球棍模型: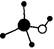 |
C.次氯酸分子的结构式: |
D.Ge原子结构示意图: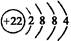 |
结合乙烯和乙醇的结构与性质,推测丙烯醇(CH2=CH—CH2OH)不能发生的化学反应是( )
| A.加成反应 | B.氧化反应 |
| C.与Na反应 | D.与Na2CO3溶液反应放出CO2 |
下列有关物质的性质或该物质性质的应用均正确的是()
| A.锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去 |
| B.二氧化硫具有还原性,浓硫酸具有强氧化性,所以不能用浓硫酸干燥二氧化硫 |
| C.MgO和Al2O3在工业上用于制作耐高温材料,也用于电解法冶炼镁、铝金属 |
| D.糖类、油脂、蛋白质在一定条件下均可以水解 |