下列说法中正确的是( )
①钠在空气中燃烧生成淡黄色的Na2O2 ②常温下铝制容器可储运浓硫酸或浓硝酸
③盐酸既有氧化性又有还原性 ④ Fe(OH)3、FeCl2、H2SiO3都不能直接用化合反应制备
⑤ SO2能使酸性高锰酸钾溶液褪色,所以它具有漂白性
| A.②③ | B.①②③ | C.①②③④ | D.①②③⑤ |
新型纳米材料氧缺位铁酸盐(MFe2Ox 3<x<4,M=Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温与氢气反应制得,常温下,它能使工业废气中的酸性氧化物(SO2、NO2等)转化为其单质除去,转化流程如图: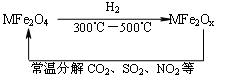
关于此转化过程的叙述不正确的是
| A.MFe2O4在与H2反应中表现了氧化性 |
| B.若4mol MFe2Ox与1mol SO2恰好完全 反应则MFe2Ox中x的值为3.5 |
| C.MFe2Ox与SO2反应中MFe2Ox被还原 |
| D.MFe2O4与MFe2Ox的相互转化反应均属于氧化还原反应 |
磷钨酸H3PW12O40等杂多酸可代替浓硫酸用于乙酸乙酯的制备。下列说法不正确的是
| A.H3PW12O40在该酯化反应中起催化作用 |
| B.杂多酸盐Na2HPW12O40与Na3PW12O40都是强电解质 |
| C.H3PW12O40、KH2PW12O40与Na3PW12O40中都有相同的原子团 |
| D.硅钨酸H4 SiW12O40也是一种杂多酸,其中W的化合价为+8 |
下列A~D四组反应中.其中I和Ⅱ可用同一个离子方程式表示的是
| I |
II |
|
| A |
把金属铁放入稀硫酸中 |
把金属铁放入稀硝酸中 |
| B |
Ca(HCO3)2溶液中加入足量的NaOH溶液 |
Ca(OH)2溶液中加入足量的NaHCO3溶液 |
| C |
将0.1 molCl2通入含0.3 mol FeBr2的溶液 |
将0.3 mol Cl2通入含0.1 mol FeBr2的溶液 |
| D |
将少量Na2CO3溶液滴入到足量HCl溶液 |
将少量HCl溶液滴入到足量Na2CO3溶液 |
已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力
而言,FeS>H2S>CuS,则下列离子方程式错误的是
| A.Mg2+ + 2HCO3- + 2Ca2+ + 4OH- = Mg(OH)2↓+ 2CaCO3↓+ 2H2O |
| B.Cu2+ + H2S = CuS↓+ 2H+ |
| C.FeS + 2H+= Fe2+ + H2S↑ |
| D.Zn2+ + S2- + 2H2O = Zn(OH)2↓+ H2S↑ |
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。下列“水” 电池在海水中放电时的有关说法正确的是
| A.正极反应式:Ag+Cl--e-=AgCl |
| B.每生成1 mol Na2Mn5O10转移2 mol电子 |
| C.Na+不断向“水”电池的负极移动 |
| D.AgCl是还原产物 |